- •Раздел III. Равновесные электродные процессы
- •Величины, характеризующие энергетическое состояние заряженных частиц
- •Эдс как сумма гальвани-потенциалов
- •Эдс как сумма вольта-потенциалов
- •Теория возникновения электродного потенциала и эдс
- •Гальвани-потенциал на границе двух металлов
- •Гальвани-потенциал на границе металл – раствор Осмотическая теория Нернста
- •Сольватационная теория электродного потенциала
- •Классификация электродов
- •Электроды первого рода
- •Электроды второго рода
- •Электроды третьего рода
- •Газовые электроды
- •Амальгамные электроды
- •Окислительно-восстановительные, или редокси-электроды
- •Физические цепи
- •Концентрационные цепи
- •Химические цепи
- •Аккумуляторы
- •Электрокинетические явления
- •Электрокапиллярные явления
- •Потенциалы нулевого заряда и нулевые точки металлов
- •Теория конденсированного двойного слоя Гельмгольца
- •Теория диффузного двойного слоя Гуи – Чапмана
- •Адсорбционная теория Штерна
- •Дальнейшее развитие теории строения дэс
Эдс как сумма вольта-потенциалов
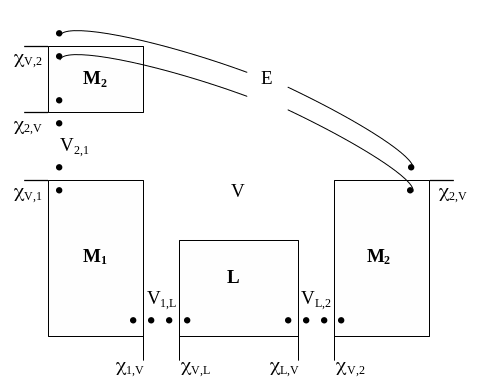
Разложение ЭДС на отдельные скачки потенциала дает дополнительные сведения о природе электрохимических систем. В то же время вышеприведенное уравнение нельзя считать удовлетворительным, так как реально измеряемая величина ЭДС выражается здесь как сумма гальвани-потенциалов, то есть потенциалов, отвечающих двум точкам, находящимся в разных фазах, и потому не поддающихся измерению или расчету. Для равновесных электрохимических систем такую неопределенность можно преодолеть, если учесть, что в равновесных процессах изменение энергии системы определяется конечным и начальным ее состояниями и не зависит от пути перехода от одного состояния к другому. На этом основании непосредственные контакты между фазами, образующими электрохимическую систему, можно заменить их контактом через вакуум (см. рис. 16).
|
Рис. 16. ЭДС электрохимической системы как сумма вольта-потенциалов |
ЭДС системы следует записать в виде суммы:
Е = V,2 + 2,V + V2,1 + V,1 + 1,V + V1,L + V,L + L,V + VL,2 + V,2 + 2,V .
Учитывая, что для любого скачка потенциала справедливо уравнение типа V, = – V, , можно написать:
Е = V2,1 + VL,2 – VL,1 .
ЭДС системы слагается теперь их трех вольта-потенциалов, каждый из которых, так же, как и сама ЭДС, может быть непосредственно измерен: все они отвечают электрической работе переноса элементарного заряда между точками в одной и той же фазе.
Измеряемая экспериментально величина ЭДС отвечает разности внутренних потенциалов точек, находящихся в двух кусках одного и того же металла, присоединенных к электродам электрохимической системы (точки b и q в М2 и М2 на рис. 15):
Е = b
– q
=
![]() –
–
![]() .
.
Ранее отмечалось, что разность
внутренних потенциалов в общем случае
неопределима, но так как М2 и М2
имеют одинаковый химический состав, то
их химические потенциалы равны (![]() =
=
![]() )
и можно написать:
)
и можно написать:
Е =
–
+
![]() –
–
![]() =
=
![]() (
(![]() –
–
![]() )
.
)
.
По вышеприведенному
уравнению ЭДС представляет собой
разность электрохимических потенциалов
элементарной заряженной частицы в М2
и М2, то есть
величину, доступную непосредственному
измерению. Для рассматриваемого случая
![]() =
=
![]() и
и
Е =
–
=
![]() +
– (
+
– (![]() +
)
=
–
=
+
)
=
–
=
![]() ,
,
то есть ЭДС равна разности внешних потенциалов вблизи двух металлических фаз одинакового химического состава (точки a и r на рис. 15), которую также можно измерить.
Таким образом, ЭДС правильно разомкнутой электрохимической системы определяется уравнением:
Е =
![]() =
=
(
–
)
.
=
=
(
–
)
.
Лекция 7
Природа ЭДС и электродного потенциала: теория возникновения ЭДС, гальвани-потенциал на границе двух металлов, гальвани-потенциал на границе металл – раствор
Теория возникновения электродного потенциала и эдс
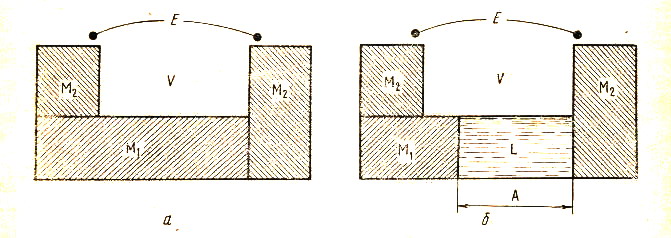
Значение электродного потенциала в общем случае не совпадает ни с нернстовским потенциалом, ни с разностью между нернстовскими потенциалами металла и электрода H+H2Pt, так как включает в себя ещё и потенциал между данным металлом и платиной. Понятие об электродном потенциале поэтому сложнее, чем понятие о скачке потенциала между электродом и раствором, и не может быть сведено к нему. Так называемая физическая теория электрохимических систем, сформулированная Вольтой ещё в начале XIX века, отводила особое место контакту между двумя разнородными металлами. По этой теории ЭДС электрохимической системы считается равной вольта-потенциалу между двумя разнородными металлами, а скачок вольта-потенциала между металлом и раствором принимается равным нулю. Возникновение тока в электрохимической системе объясняется при этом следующим образом (см. рис. 17). Если привести в непосредственное соприкосновение два различных металла, то ЭДС не возникнет, так как
E =
–
=
![]() +
+
![]() =
–
= 0 .
=
–
= 0 .
Если непосредственный контакт между двумя металлами заменить их контактом через токопроводящий раствор, то ЭДС уже будет равна не нулю, а величине
E =
–
=
+
![]() +
+
![]() =
,
=
,
потому что
и
![]() =
0. В результате через систему потечёт
электрический ток, то есть она будет
генерировать электрическую энергию.
=
0. В результате через систему потечёт
электрический ток, то есть она будет
генерировать электрическую энергию.
|
Рис. 17. Схема, иллюстрирующая появление ЭДС при переходе от системы, составленной из двух металлов (а), к системе из тех же двух металлов, но разделенных слоем раствора (б), согласно представлениям физической теории |
Теория Вольты игнорирует нернстовские скачки потенциала и, таким образом, не может объяснить существования зависимости ЭДС от концентрации электролита. Помимо этого, она противоречит закону сохранения энергии, постулируя получение энергии просто из существования неизменного скачка потенциала на стыке двух металлов, то есть по существу из ничего. Физическая теория Вольты была подвергнута критике вскоре после её создания. В 1805 г. Риттер высказал взгляды, положившие начало химической теории ЭДС. Согласно этой теории, получившей наиболее полное развитие в трудах Нернста и Оствальда, источником электрической энергии являются химические реакции, протекающие на границах раздела электрод – электролит. Химическая теория верно определяет природу источника электрической энергии электрохимических систем. Она лежит в основе количественных термодинамических выражений для ЭДС и электродных потенциалов.
Вместе с тем в химической теории предполагается, что ЭДС электрохимической системы слагается только из двух скачков потенциала, возникающих на тех границах раздела, где протекают токообразующие химические реакции, то есть на границах раздела электрод – электролит. При этом электродные потенциалы отождествляются со скачками потенциалов между электродом и раствором, а ЭДС – с разностью этих скачков:
Е
=
![]() –
–
![]() . (1)
. (1)
Роли скачка потенциала на стыке двух металлов в появлении ЭДС теория не учитывает. Эти представления химической теории не отвечают действительности, и ЭДС электрохимической системы слагается из трёх скачков потенциала.
Характер связи между ЭДС и отдельными скачками потенциала можно выяснить на примере электрохимической системы, состоящей из двух металлов, опущенных в растворы их токопроводящих соединений:
М1М1АМ2АМ2М1 .
Её ЭДС определяется уравнением E = V2,1 – VL,1 + VL,2 , так как диффузионный потенциал на границе двух растворов элиминирован. Если каким либо способом (например, подбором соответствующих составов растворов М1А и М2А) устранить скачки потенциала VL,1 и VL,2 , то ЭДС системы, вопреки представлениям химической теории, будет равна не нулю, а вольта-потенциалу металл 1 – металл 2:
E = п – л = V2, 1 . (2)
Электродные потенциалы, отвечающие таким вполне реализуемым на опыте условиям, были названы А.Н.Фрумкиным потенциалами нулевого заряда.
Имеются, однако, электрохимические системы, например, простая химическая цепь с газовыми электродами
PtH2 H2OO2 Pt ,
в которых вообще нет контакта
между двумя разными металлами и,
следовательно, потенциал
![]() не участвует в создании ЭДС. В подобных
случаях ЭДС системы определяется
уравнением (1), которое является прямым
следствием химической теории. Наличие
потенциала между двумя разными металлами
нельзя считать, таким образом, обязательным
условием появления ЭДС и получения
энергии от электрохимической системы.
Электрическую энергию можно получать,
вопреки представлениям физической
теории, от электрохимической системы,
в которой оба электрода сделаны из
одного и того же металла.
не участвует в создании ЭДС. В подобных
случаях ЭДС системы определяется
уравнением (1), которое является прямым
следствием химической теории. Наличие
потенциала между двумя разными металлами
нельзя считать, таким образом, обязательным
условием появления ЭДС и получения
энергии от электрохимической системы.
Электрическую энергию можно получать,
вопреки представлениям физической
теории, от электрохимической системы,
в которой оба электрода сделаны из
одного и того же металла.
Таким образом, в зависимости от конкретных условий ЭДС электрохимической системы определяется либо гальвани-потенциалом между двумя разнородными металлами, либо гальвани-потенциалами на стыке металлов и раствора, либо всеми тремя скачками потенциала. Иными словами, в одних случаях реализуется механизм образования ЭДС, постулированный физической теорией, в других – химической, в третьих – все скачки потенциала вносят свой вклад в величину ЭДС, то есть в какой-то мере каждая из двух теорий отражает истинные соотношения. В этом состоит одно из решений так называемой проблемы Вольты, данное А.Н.Фрумкиным и основанное на концепции потенциалов нулевого заряда.