
- •Визначення залежності швидкості хімічних реакцій від різних умов
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •4.1. Вплив температури на швидкість реакції.
- •4.2. Вплив поверхні зіткнення на швидкість хімічної реакції.
- •4.3. Вплив каталізатора на швидкість хімічної реакції,
- •4.4. Вплив інгібітору на швидкість хімічної реакції.
- •5. Вимоги до звіту
- •6. Техніка безпеки
- •7. Контрольні питання
- •8. Література
- •Вивчення моделі проточного трубчастого реактора
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади і посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Вивчення моделі реактору ідеального змішування
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2.Хімічні реактиви, прилади, посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання нафтопродуктів прямою перегонкою нафти
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •Визначення густини пікнометром
- •Визначення в 'язкості
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи.
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Дослідження корозії металів
- •1. Теоретичні основи
- •Показники корозії металів
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •Отримання їдкого натрію (NаOh) і хлору електрохімічним методом
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3.Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •Одержання сульфату амонію
- •1.Теоретичні основи
- •2.Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4.Послідовність виконання роботи
- •5.Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Послідовність виконання роботи
- •3.1 Визначення твердості води
- •3.2 Визначення хлоридів
- •3.3 Визначення масової концентрації двовалентного і тривалентного заліза
- •3.4 Визначення масової концентрації міді
- •3.5 Визначення масової концентрації хрому
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Одержання і дослідження конденсаційних смол (новолочна смола)
- •Теоретичні основи
- •2. Хімічні реактиви та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
- •5. Опрацювання результатів
- •6. Вимоги до звіту
- •7. Техніка безпеки
- •8. Контрольні питання
- •9. Література
- •Очищення хімічних реагентів ( реактивів) методом прямої перегонки
- •1. Теоретичні основи
- •2. Хімічні реактиви, прилади та посуд
- •3. Опис лабораторної установки
- •4. Послідовність виконання роботи
1.Теоретичні основи
Електрохімічні процеси – це процеси, де проходить перетворення електричної енергії в хімічну, або хімічної енергії в електричну. Електрична енергія перетворюється в хімічну при електролізі розчинів. Цей процес широко використовується в хімічній промисловості для отримання, кисню, водню, хлору, лугів та ін.
Електроліз – це процес розкладання електролітів під дією постійного електричного струму з утворенням нових речовин. При наявності напруги на електродах аніони електроліту рухаються до аноду, а катіони до катоду. Хімічна сутність процесу – це окисно-відновні реакції на електродах.
Електроліз розчину хлориду натрію є найбільш типовим прикладом електрохімічного процесу в водному розчині. Це найбільш простий та економічний метод отримання цінних продуктів (хлору, водню, їдкого натрію).
Процес проводиться в електролітичній ванні з залізним катодом та графітовим анодом. З анодного простору виділяється хлор, насичений водяним паром, а з катодного – відводиться луг (NaOH), водень, водяна пара.
Процеси які відбуваються на катоді:
2H2O+2e-=H2+2OH![]()
OH +Na+=NaOH
Процеси які відбуваються на аноді:
2Cl-=Cl2+2e-
Сумарний процес електролізу:
2NaCl+2H2O=Cl2+H2+2NaOH
Побічні реакції на аноді:
2OH -2e-=2H2O+1/2O2
C+O2=CO2
2Cl-+9H2O=2ClO-3+1.5O2+18H++18e-
В розчині відбуваються вторинні хімічні реакції:
Cl2+H2O↔HClO+HCl; HClO+NaOH=NaClO+H2O
HCl+NaOH=NaCl+H2O; 2NaClO↔NaClO3+2NaCl
Всі ці побічні реакції знижують процес виходу по струму по основних продуктах. Щоб запобігти виникненню побічних реакцій, необхідно щоб продукти електролізу не змішувались. Для цього застосовують протиток електроліту і пористі діафрагми – перегородки, які розділяють катодний і анодний простір. Підвищенню виходу продукту по струму сприяє висока початкова концентрація NaCl (305 – 310 г/дм3) і підвищення температури до 70 – 80 0С.
2.Хімічні реактиви, прилади та посуд
Реактиви:
Розчин NaCl С = 310г/дм3
Соляна кислота 0.1н розчин
Фенолфталеїн
Дистильована вода
Прилади та посуд
Електролітична ванна з електродами……………………….1 шт
Випрямляч струму……………………………………………1 шт
Термометр…………………………………………………….1 шт
Напірна ємкість V=5 л……………………………………….1 шт
Приймач V=5 л……………………………………………….1 шт
Колби V=100 мл……………………………………………...5 шт
Піпетки V=10 мл……………………………………………..2 шт
Бюретка V=25 мл…………………………………………….1 шт
Індикаторний папір…………………………………………. 1 шт
3.Опис лабораторної установки
Лабораторна установка для проведення електролізу хлориду натрію складається з електролітичної ванни (1) та двох електродів: залізного (катоду) (2) та графітового (аноду) (3) , які під’єднуються до випрямляча струму (4). Подача хлориду натрію в електролізер здійснюється з напірної ємкості (5), отриманий їдкий натр зливається в ємкість-приймач (6).
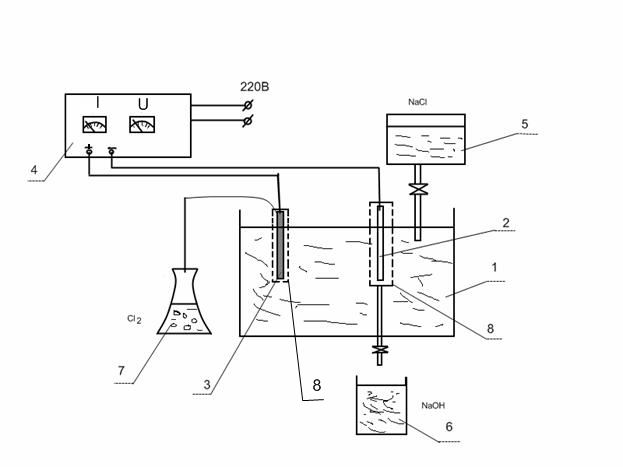
1 – електролітична ванна (електролізер); 2 – залізний катод;
3 – графітовий анод; 4 – випрямляч струму; 5 – напірна ємкість;
6 – приймач NaOH; 7 – склянка-уловлювач Cl2;
8 – напівпроникні перегородки для електродів
Рисунок 8.1 – Установка для електролізу NaCl
Для запобігання протікання побічних реакцій (змішування) використовуються напівпроникні перегородки (8). Хлор який виділяється в ході електролізу направляється в склянку-приймач (7) з дистильованою водою, де утворюється хлорна вода з характерним запахом. Увага! Робота проводиться під включеною витяжною шафою, з закритими вікнами.
