
4.1 Обратимые реакции.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
С точки зрения полноты протекания все реакции подразделяются на необратимые (проходят до конца, на 100%, завершаются при полном расходовании одного или нескольких реагентов) и обратимые (полнота протекания менее 100%, реагенты полностью не расходуются, такие реакции завершаются установлением равновесия). Большинство процессов в той или иной степени обратимы:

Практически необратимыми оказываются реакции, в которых какой–либо продукт в условиях реакции оказывается малоактивным по отношению к имеющимся в системе веществам,
2
Н2
+ О2
![]() 2 Н2О
2 Н2О
особенно, если он еще и удаляется из сферы реакции:
Zn
+ H2SO4
![]() ZnSO4
+ H2↑
ZnSO4
+ H2↑
Обсудим закономерности протекания обратимых реакций на примере взаимодействия оксида углерода СО и кислорода. Если поместить их в некоторую закрытую систему и контролировать концентрации (парциальные давления) веществ, то можно будет убедиться, что при комнатных температурах они меняться не будут. То есть состояние системы будет оставаться неизменным, хотя термодинамически выгодным является образование СО2:
2 СО (г) + О2 (г) = 2 СО2 (г) (13)
ΔGoр-ции= – 514 кДж, ΔНo = – 568 кДж, ΔSo = –0.173 кДж/К
Это
не удивительно, учитывая строение
молекул реагентов
(![]() ),
— велика энергия активации реакции, а
поэтому константа скорости (скорость)
практически равна нулю. Если повысить
температуру до 600 °С и далее поддерживать
условия неизменными, то концентрации
СО и кислорода станут уменьшаться,
одновременно в системе появится оксид
углерода (IV)
СО2,
причем его концентрация (парциальное
давление) станет увеличиваться. Стало
быть можно сделать вывод, что началась
реакция образования СО2.
В соответствие с кинетическим уравнением
),
— велика энергия активации реакции, а
поэтому константа скорости (скорость)
практически равна нулю. Если повысить
температуру до 600 °С и далее поддерживать
условия неизменными, то концентрации
СО и кислорода станут уменьшаться,
одновременно в системе появится оксид
углерода (IV)
СО2,
причем его концентрация (парциальное
давление) станет увеличиваться. Стало
быть можно сделать вывод, что началась
реакция образования СО2.
В соответствие с кинетическим уравнением
![]() =
=
![]() ·РСО2·РО2
=
·РСО2·РО2
=
![]() ·[СО]2·[О2]
(14)
·[СО]2·[О2]
(14)
скорость реакции будет постепенно уменьшаться, т.к. исходные вещества расходуются, следовательно, концентрации веществ будут меняться все слабей, медленней. Более того, через некоторое время наступит момент, когда концентрации веществ перестанут меняться (рис.9). Но этого не может быть по причине прекращения реакции, т.к. ни один из сомножителей в уравнении (14) не равен нулю. Следовательно, наряду с реакцией образования СО2 в системе проходит и реакция его разложения с образованием исходных веществ
2 СО2 (г) = 2 СО (г) + О2 (г) ,
п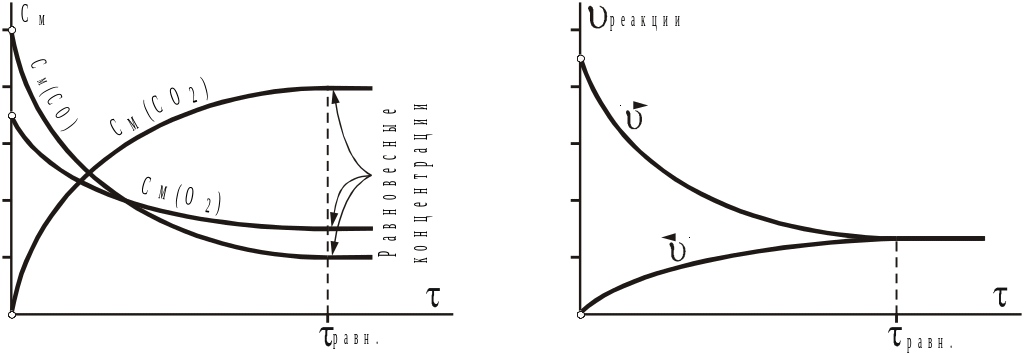 ричем
скорости этих реакций одинаковы
ричем
скорости этих реакций одинаковы
![]() =
=
![]() ·РСО22
=
·РСО22
=
![]() ·[СО2]2.
(15)
·[СО2]2.
(15)
а б
Рис.9
Изменение концентраций веществ (а),
а также скоростей прямой и обратной
реакций (б)
процессе достижения равновесия:
2
СО + О2
![]() 2 СО2
2 СО2
В соответствии с результатами этого мысленного эксперимента можно дать новое определение для обратимых реакций: это такие реакции, когда в системе одновременно происходят два противоположных процесса, т.е. продукты прямой реакции одновременно являются реагентами для обратной реакции. Состояние, при котором скорости обеих реакций одинаковы, называется химическим (динамическим) равновесием. Макроскопические характеристики такой системы постоянны, т.е. с термодинамической точки зрения ни один из процессов не преобладает над противоположным, поэтому ΔG = 0 – термодинамическое условие равновесия.
Равновесие
устанавливается за счет постепенного
выравнивания скоростей (рис.9 б):
до тех пор пока скорость прямой реакции
больше, чем скорость обратной, СО2
больше образуется, чем расходуется,
поэтому его концентрация (парциальное
давление) растет, соответственно
увеличивается
![]() .
По
аналогичной причине уменьшается
.
По
аналогичной причине уменьшается
![]() .
С
момента установления равновесия
концентрации перестают меняться,
следовательно перестают меняться и
скорости.
.
С
момента установления равновесия
концентрации перестают меняться,
следовательно перестают меняться и
скорости.
Важной количественной характеристикой состояния равновесия является константа равновесия: КС или КР. В состоянии равновесия
= .
Тогда, приравнивая выражения (4.2) и (4.3), получаем
·РСО2·РО2 = ·РСО22 ·[СО]2·[О2] = ·[СО2]2.
В этих равенствах по две постоянные для данной температуры величины (константы скоростей). Их можно объединитьв одну костанту, если поделить обе части левого равенства на ·РСО2·РО2 , а правого — на ·[СО]2·[О2].
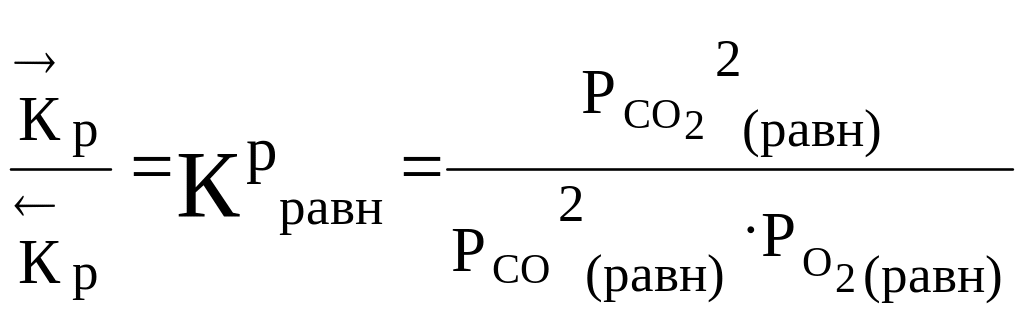
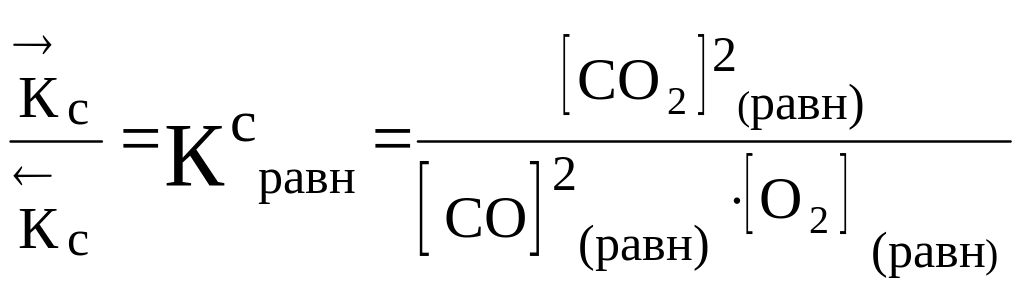
В общем случае для равновесия
aA
(тв)
+ bB
(р-р)
+ cC
(р-р)
![]() dD
(р-р)
+ eE
(р-р)
dD
(р-р)
+ eE
(р-р)
Кравн
=
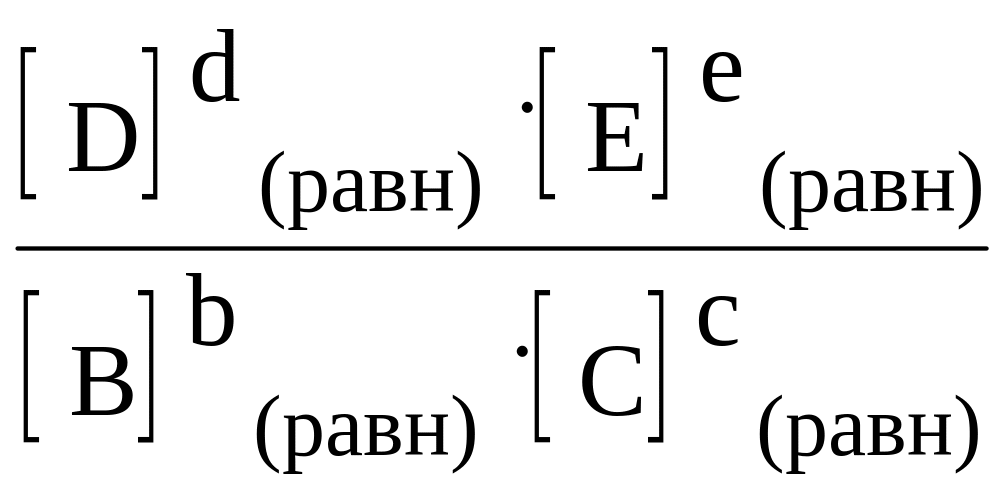 .
(16)
.
(16)
Если обратимая реакция походит в газовой фазе
aA
(тв)
+ bB
(г)
+ cC
(г)
![]() dD
(г)
+ eE
(г)
,
dD
(г)
+ eE
(г)
,
то формула для константы равновесия имеет вид:
Кравн
=
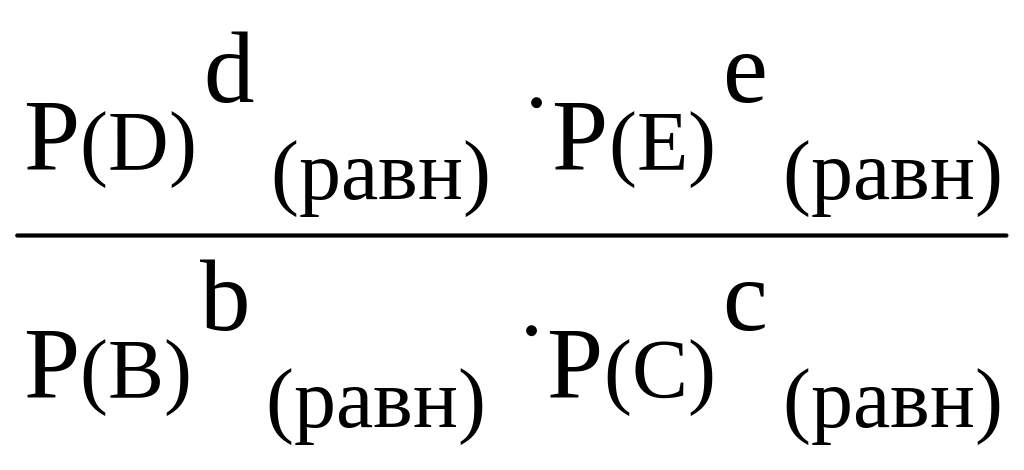 .
(17)
.
(17)
В выражения для констант равновесия входят равновесные, т.е. уже неизменные концентрации (парциальные давления) участников обратимой реакции. По величине константы равновесия можно качественно оценить и даже рассчитать степень превращения: если Кравн >> 1, значит числитель в формулах (16) и (17) больше знаменателя, а это равносильно тому, что в состоянии равновесия продуктов больше, чем реагентов (полнота протекания реакции высокая). И наоборот, при условии Кравн << 1 продуктов в состоянии равновесия крайне мало.
При неизменных внешних условиях состояние равновесия будет сохраняться бесконечно долго. Но, если на систему, находящуюся в состоянии динамического равновесия оказать внешнее воздействие (изменить температуру, концентрацию (парциальное давление) какого–либо из участников равновесия или общее давление (объем системы)), то равновесие, как правило, нарушается. В системе станет преобладать (протекать с большей скоростью) та реакция, которая способна уменьшить оказанное воздействие. Это правило известно, как принцип Ле Шателье.
Рассмотрим влияние внешних условий на обсуждаемое равновесие. Например, если повысить температуру, то в соответствии с правилом Вант–Гоффа (законом Аррениуса) скорости обеих реакций увеличатся (рис. 10). По принципу Ле Шателье равновесие должно сместиться в сторону той реакции, которая способна понизить температуру, т.е. в сторону эндотермической (обратной) реакции. Итак, в этом случае равновесие смещается влево, и некоторое время будет преобладать обратная реакция. Если воздействие будет одноразовым, то в системе вновь установится равновесие, но при новой температуре. Из уравнения Вант–Гоффа, а также из анализа энергетической диаграммы нетрудно понять, что такое изменение скоростей происходит потому, что эндотермическая реакция имеет больший температурный коэффициент скорости, чем одновременно с ней, противоположно идущая экзотермическая. Изменение температуры тем сильней будет влиять на равновесие, чем сильней отличается от нуля энтальпия реакции (что равносильно большой разнице в энергиях активации, температурных коэффициентах прямой и обратной реакций).
Если в момент времени τ2 понизить общее давление, например, в ~1.414 раза, то система должна повысить давление. Это возможно за счет реакций, в ходе которых увеличивается количество моль газов. В данном случае это обратная реакция, таким образом, равновесие сместится влево (от давления не зависят равновесия, в которых не участвуют газообразные вещества или число моль газов среди реагентов и продуктов одинаково). Обосновать эти процессы можно по–разному: или с использованием кинетических уравнений, или на основе формулы для Кравн.
Понижение общего давления равносильно такому же изменению парциального давления каждого газа. В соответствии с уравнениями (14) и (15) скорости обеих реакций уменьшатся, но скорость прямой уменьшится в 1.4143 ≈ в 4 раза, а скорость обратной реакции уменьшится только в 1.4142 ≈ в 2 раза.
Рис.11 Схема влияния
катализатора на ускорение достижения
равновесия.
Рис.10
Последствия влияния температуры (τ1),
общего давления (τ2)
и
парциального давления О2
(τ3)
на
равновесие
2
СО + О2
2 СО2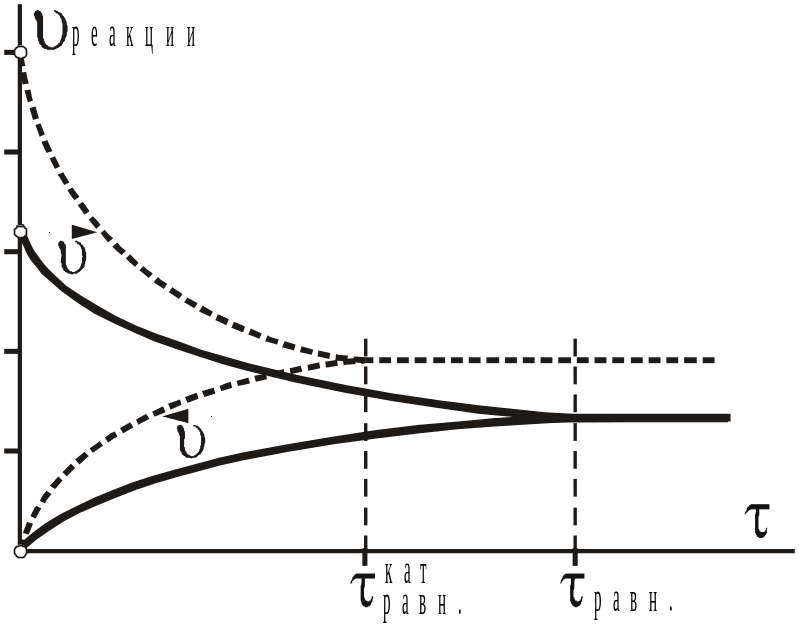

В итоге скорость обратной реакции будет превышать скорость прямой (рис.10) и равновесие сместится влево. Если кинетические уравнения неизвестны, то влияние давления можно продумать по константе равновесия:
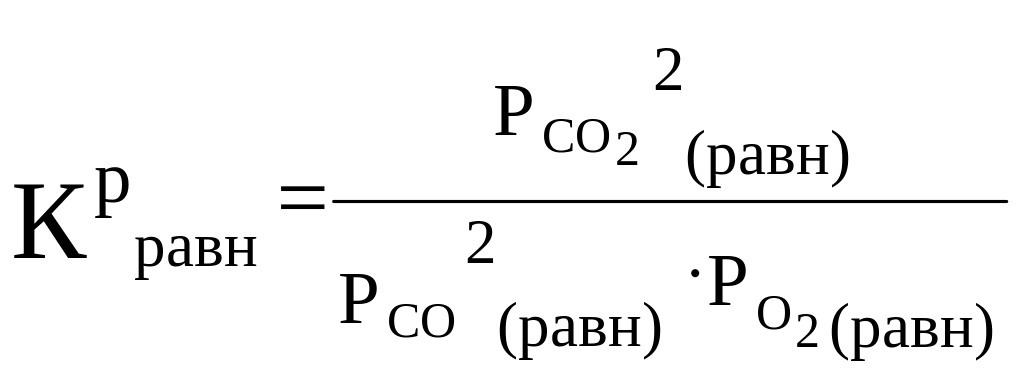 (18)
(18)
Так как парциальное давление каждого реагента понизилось в 1.414 раза, то числитель дроби уменьшился в 2 раза, а знаменатель — в 4 раза. В итоге дробь увеличилась. Но константа равновесия Крравн от давления не зависит, это равновесные давления должны принимать значения в соответствии с величиной константы равновесия. Поэтому, если дробь увеличилась, значит, она стала больше константы равновесия — равновесие нарушилось. За счет идущих в системе реакций оно вновь будет восстанавливаться, для этого должна уменьшиться дробь, что возможно за счет повышения парциального давления (концентрации) реагентов и понижения парциального давления (концентрации) продукта. Это, в свою очередь, равносильно смещению равновесия влево, в сторону реагентов. То есть вывод о влиянии давления на равновесие подтвердился.
Аналогичные рассуждения можно выполнить для объяснения влияния концентрации (давления) того или иного участника равновесия в отдельности. Например, если в момент τ2 увеличить парциальное давление (концентрацию) кислорода в два раза, в соответствии с кинетическими уравнениями скорость прямой реакции возрастет в два раза, а скорость обратной реакции не изменится, т.к. концентрация (давление) кислорода входит только в уравнение для скорости прямой реакции (см. (14) и (15)). В итоге равновесие на некоторое время нарушится в пользу прямой реакции.
В заключение следует отметить, что катализаторы одинаково снижают энергии активации как прямой, так и обратной реакций. Они обе ускоряются одинаково. При этом равновесие не нарушается, но в присутствии катализаторов оно достигается быстрей (рис.11).
1 Неверно думать, что скорость реакции будет снижаться при увеличении объема гомогенной системы или площади поверхности соприкосновения реагентов (в гетерогенной). Наличие этих величин в знаменателе означает, что скорость контролируется в выбранном микрообъеме (на элементарной площади). В соседних единицах пространства реакция идет с той же скоростью. Чем больше будет объем (площадь), тем больше продукта будет получено за единицу времени, тем больше общая скорость превращения.
2 Полная скорость реакции находится суммированием удельных скоростей по всему объему гомогенной реакции и по всей площади поверхности соприкосновения реагентов гетерогенной реакции:
![]() или
или
![]()
![]() или
или
![]() .
Таким образом полная скорость гомогенной
реакции пропорциональна объему системы,
а полная скорость гетерогенной
пропорциональна площади поверхности
соприкосновения реагентов.
.
Таким образом полная скорость гомогенной
реакции пропорциональна объему системы,
а полная скорость гетерогенной
пропорциональна площади поверхности
соприкосновения реагентов.
3
Поскольку площадь контакта веществ в
гетерогенной реакции редко удается
определять с хорошей точностью, обычно
скорость приводят к общей массе системы:
![]() .
.
4 Радикалами называются простые или сложные частицы, содержащие неспаренные электроны: Cl·, H·, ·CH3 , HO· (не путать с ионом ОН - ), Na·(г) и т.п. Обычно они существуют очень короткое время и активно стремятся к образованию "недостающих" связей. Поэтому реакции с участием радикалов, как правило, развиваются с очень большими скоростями и в газовой фазе нередко сопровождаются взрывом.
5 Пусть в системе протекает одностадийная реакция 2А(р-р) + В(р-р) → А2В. Скорость реакции будет пропорциональна W2А,В—вероятности одновременного столкновения двух молекул А с одной молекулой В:
![]() .
.
Вероятность того, что в конкретный момент времени молекула В окажется в некоторой выбранной точке пространства пропорциональна концентрации соответствующих молекул:
WB = KB·CB
Вероятность того, что в тот же момент времени в той же области пространства окажутся две молекулы А равна
W2A = KA·CA·KA·CA.
Тогда вероятность столкновения трех частиц равна произведению вероятностей отдельных событий:
W2A,B = W2A· WB .
В
итоге получаем:
![]() .
.
6 Для реакций, идущих в газовой фазе, корректней пользоваться выражением, связывающим скорость и парциальные давления реагентов. При этом следует понимать, что парциальное давление каждого газа в смеси через уравнение Менделеева–Клапейрона однозначно определяет его молярную концентрацию:
![]()
7 Молекулярность – число частиц, участвующих в элементарном акте взаимодействия.
8 Порядки в некоторых случаях находятся теоретически, но всегда сверяются со значениями, полученными при обработке кинетических экспериментов. Для одностадийных реакций молекулярность (a + b) и суммарный порядок (m + n) обязательно совпадают, а для сложных – могут оказаться одинаковыми лишь случайно.
9 Концентрации (парциальные давления) твердых веществ в явном виде не присутствуют в кинетических уравнениях, т.к. они постоянны и учитываются в константах скоростей.
10 Кроме того, в момент столкновения молекулы должны быть сориентированы строго определенным образом. Например, при гадрировании алкенов
CnH2n
+ H2
![]() CnH2n+2
CnH2n+2
молекула водорода должна оказаться вблизи кратной связи. Причем, следует понимать, что вероятность такого события будет уменьшаться с ростом n.
