
Учебно-методическое пособие разработано кандидатом химических наук, доцентом кафедры общей и неорганической химии Бикяшевым Э.А..
Ответственный редактор – доктор химических наук, профессор Лупейко Т.Г.
Печатается в соответствии с решением кафедры общей и неорганической химии РГУ, протокол № 8 от 30 августа 2006 г.
1 Сопоставление ОсновныХ идей
химической ТЕРМОДИНАМИКИ
И химической кинетики
Принципиальную возможность осуществления того или иного химического процесса можно оценить, используя термодинамический метод анализа систем, применяя законы химической термодинамики (по величине изменения изобарно-изотермического потенциала реакции ΔG). Однако с термодинамических позиций невозможно определить скорость, механизм превращения и даже ее реальную возможность в данных конкретных условиях. Например, реакция взаимодействия оксида азота (II) с кислородом
2 NO (г) + O2 (г) = 2 NO2 (г) ΔG˚ = – 150 кДж
проходит очень быстро при комнатной температуре. В то время как реакция
2 Н2 (г) + О2 (г) = 2 Н2О (г) ΔG˚ = – 456.5 кДж,
характеризующаяся значительно большим уменьшением свободной энергии Гиббса, в обычных условиях практически не протекает. Смесь водорода с кислородом сохраняется при комнатной температуре без заметных признаков взаимодействия очень длительное время, но в присутствии катализатора (Pt – губка) или при 700 ˚С (ΔG˚1000 К = - 495.3 кДж) процесс завершается практически мгновенно. Подобные примеры можно привести и из химии органических соединений: многие из них термодинамически нестабильны как к разложению на простые вещества, так и к окислению:
С2Н2 = 2 С (графит) + Н2 (г) ΔG˚ = –209 кДж
2 С2Н2 + 3 О2 = 2 СО2 (г) + 2 Н2О (г) ΔG˚ = –828 кДж
Однако на самом деле в стандартных условиях эти не реакции не проходят. Таким образом, термодинамическая возможность осуществления той или иной реакции (ΔG < 0) является необходимым, но недостаточным условием реализации процесса в действительности. Протекание химической реакции всегда связано с преодолением энергетических барьеров, которые иногда могут быть весьма значительными. Закономерности развития химических реакций во времени, механизм их протекания изучает особый раздел теоретической химии ― химическая кинетика.
Обсудим основные идеи кинетического анализа химических процессов в сопоставлении с термодинамическим подходом.
Законы термодинамики позволяют, не вдаваясь в строение веществ, анализируя некоторые термодинамические параметры (например, температуру, давление, молярные концентрации тех или иных веществ) делать выводы о том, возможен ли в данных условиях переход из состояния с выбранными концентрациями веществ в состояние с новыми предполагаемыми концентрациями продуктов. Обычно при этом полностью избавиться от реагентов не удается. В этом случае можно рассчитать полноту перехода, константу равновесия. Для выполнения термодина-мических расчетов необходимо знать какими будут изменения некоторых функций состояния системы в ходе анализируемого превращения. |
|
Кинетика на основе строения реагентов, продуктов, а также дополнительно присутствующих в системе веществ (например, растворителя) позволяет спрогнозиро-вать скорость превращения, предсказать закономерности измене-ния во времени концентрации тех или иных веществ. Учитывая активность продуктов в условиях реакции, можно качественно оценить возможную степень превращения и при необходимости рассчитать время, необходимое для установления равновесия. Законы кинетики позволяют учесть влияние внешних условий (температуры, парциального давления газов, концентрации реагентов) на скорость реакции. Кинетические уравнения очень сильно зависят от агрегатного состояния веществ. |
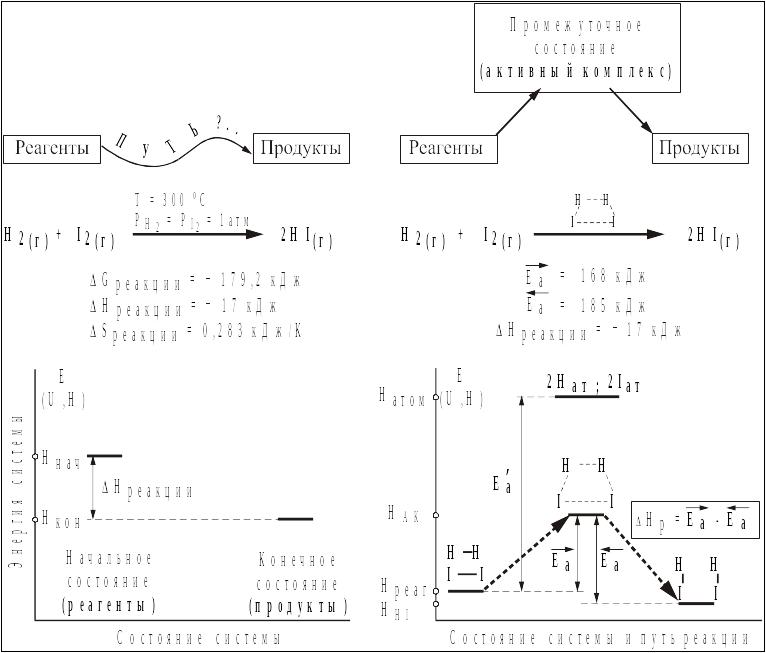
Рис.1 Схема, иллюстрирующая некоторые различия термодинамического и кинетического методов анализа химических процессов.
(Комментарий рисунка и использованных
понятий будет дан в последующих разделах).
В основе термодинамики лежит сравнение выгодности разных состояний, но никак не анализируется способ перехода, "путь реакции". Более предпочтительными с термодинамической точки зрения являются экзотермические реакции (ΔН < 0), тем более, если одновре-менно увеличивается термодинами-ческая вероятность состояния системы (ΔS > 0). |
В основе кинетического анализа лежит утверждение, что строение реагентов, а также дополнительно присутствующих в системе веществ влияют на способ перехода, сказываются на характе-ристиках промежуточных переходных состояний (активных комплексов). Наиболее выгодными с кинетической точки зрения являются реакции, в ходе которых легче всего реализуются промежу-точные состояния (реакции с минимальной энергией активации). |
