
2 Основные понятия химической кинетики
Исходным и основополагающим понятием в химической кинетике является понятие о скорости химической реакции. Поскольку взаимодействие происходит в результате столкновения структурных единиц (молекул, ионов, атомов) реагирующих веществ, скоростью реакции логично считать число (количество) таких элементарных актов взаимодействия в единицу времени в единице пространства системы:

Эти формулы1 позволяют ввести понятие скорости реакции, но не дают возможности выполнять расчеты, т.к. регистрировать такие события, как элементарные акты перегруппировки атомов в большинстве случаев невозможно. Формулы, применяемые для расчетов должны содержать макроскопически измеряемые величины (количества, концентрации веществ).
|
|
Под удельной скоростью гомогенной реакции понимают изменение количества любого из реагентов или продуктов за единицу времени в единице объема:
|
Под удельной скоростью2 гетерогенной реакции понимают изменение количества любого из реагентов или продуктов за единицу времени на единице площади поверхности соприкосновения реагентов3:
|
![]()
![]()
![]() .
(1)
.
(1)
Рис.2
Типичное изменение концентрации
веществ в необра-тимо идущих реакциях. Выбор
знака зависит от того, концентрация
какого вещества контролируется. Для
реакций, идущих практически необратимо
концент-рации реагентов и продуктов со
временем меняются обычно в соответствии
с рис.2. Если скорость реакции рассчитывается
по реагенту, то перед дробью в формуле
(1) предполагается знак "минус" и
наоборот. Тогда в обоих случаях значение
скорости реакции оказывается положительным.
Выбор
знака зависит от того, концентрация
какого вещества контролируется. Для
реакций, идущих практически необратимо
концент-рации реагентов и продуктов со
временем меняются обычно в соответствии
с рис.2. Если скорость реакции рассчитывается
по реагенту, то перед дробью в формуле
(1) предполагается знак "минус" и
наоборот. Тогда в обоих случаях значение
скорости реакции оказывается положительным.
Рис.3
Кинетическая кривая, демонстриру-ющая
уменьшение средней и мгновенной скорости
простой реакции со временем. Результаты
многочисленных экспериментов
свидетельствуют о том, что скорость
реакций с течением времени, как правило,
уменьшается. Поэтому формула
(1) характеризует среднюю
скорость в интервале времени Δτ.
Например, на рис.3 показано, что за одни
и те же промежутки времени концентрация
реагента уменьшается все слабей. Поэтому
в кинетике чаще пользуются понятием
мгновенная скорость
реакции ― скорость в
данный момент времени. В случае гомогенной
реакции выражение для мгновенной
скорости имеет вид:
Результаты
многочисленных экспериментов
свидетельствуют о том, что скорость
реакций с течением времени, как правило,
уменьшается. Поэтому формула
(1) характеризует среднюю
скорость в интервале времени Δτ.
Например, на рис.3 показано, что за одни
и те же промежутки времени концентрация
реагента уменьшается все слабей. Поэтому
в кинетике чаще пользуются понятием
мгновенная скорость
реакции ― скорость в
данный момент времени. В случае гомогенной
реакции выражение для мгновенной
скорости имеет вид:
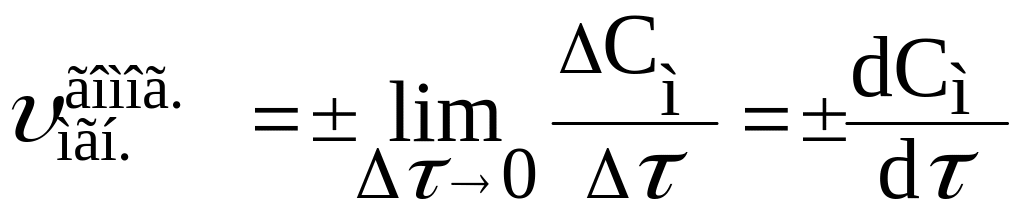 (2)
(2)
Геометрически она находится как тангенс угла наклона касательной к кривой изменения концентрации выбранного вещества (рис.3).
Следует иметь в виду, что изменения концентраций участников реакции пропорциональны их стехиометрическим коэффициентам в уравнении. Поэтому, например, для реакции:
![]()
скорость по реагенту А не будет совпадать со скоростью по продукту С:
![]() .
.
Но, если учесть, что
![]() ,
(3)
,
(3)
то можно ввести понятие об истинной скорости реакции:
![]() .
.
Характер протекания химического превращения во времени существенно зависит от ее механизма. По механизму все реакции подразделяют на простые и сложные.
Реакция называется простой, если продукт накапливается в результате непосредственного столкновения структурных единиц реагентов. Простые реакции называются также одностадийными.
Реакция называется сложной, если конечный продукт получается в результате осуществления двух и более простых реакций (элементарных актов) с образованием промежуточных продуктов.
По кинетическому механизму все сложные реакции подразделяются на два больших класса: последовательные и параллельные.
Последовательными называются сложные реакции, в которых продукт первой стадии является реагентом для второй и так далее, пока не будет получен конечный продукт Р.
S → X1 → X2 → X3 → … → P.
Примером такого рода реакции является взаимодействие водорода с оксидом азота (II):
2
NO(г)
+ 2 H2(г)
![]() 2 H2O(г)
+ N2(г)
2 H2O(г)
+ N2(г)
На основе кинетического анализа, а также с использованием спектроскопических методов было показано, что она развивается в три стадии:
2
NO
(г)
![]() N2O2
(г)
N2O2
(г)
N2O2
(г) + H2
(г)
![]() N2
(г) + H2O2
(г)
N2
(г) + H2O2
(г)
H2O2
(г) + H2
(г)
![]() 2 H2O
(г)
2 H2O
(г)
Многостадийно развиваются все биохимические процессы. Например, внутриклеточное окисление глюкозы до углекислого газа и воды осуществляется в результате более двух десятков простых реакций.
Параллельными называются сложные реакции, в которых одно и то же вещество одновременно участвует в нескольких реакциях:

Н апример,
при нагревании выше 300 ˚С бертолетова
соль разлагается по двум параллельно
идущим реакциям:
апример,
при нагревании выше 300 ˚С бертолетова
соль разлагается по двум параллельно
идущим реакциям:
Другим простым и хорошо известным примером является взаимодействие лития с основными компонентами воздуха:
![]()
Особым важным случаем сложных реакций являются цепные свободнорадикальные реакции ― процессы, в которых превращение исходных веществ в продукты осуществляется путем регулярного чередования нескольких реакций с участием свободных радикалов.4 К свободнорадикальным
о![]() тносятся,
например, реакции хлорирования алканов
(метана), горение водорода в хлоре,
взаимодействие водорода с кислородом
и др. Инициируются они с термического
(t),
фотохимического (hν)
или вызванного воздействием электрическими
разрядами ( ) разрыва наименее прочных
связей в молекулах реагентов. В реакции
водорода с кислородом связи в обеих
молекулах достаточно прочны, поэтому
зарождение цепи наиболее вероятно в
результате столкновения и одновременного
возбуждения молекул. Образовавшиеся
радикалы взаимодействуют с исходными
молекулами так, что в каждом элементарном
акте взамен одного радикала получается
новый. Продукт реакции накапливается
в результате многократного повторения
последовательности одних и тех же
реакций. Длина такой реакционной цепи
может достигать десятков и сотен тысяч.
тносятся,
например, реакции хлорирования алканов
(метана), горение водорода в хлоре,
взаимодействие водорода с кислородом
и др. Инициируются они с термического
(t),
фотохимического (hν)
или вызванного воздействием электрическими
разрядами ( ) разрыва наименее прочных
связей в молекулах реагентов. В реакции
водорода с кислородом связи в обеих
молекулах достаточно прочны, поэтому
зарождение цепи наиболее вероятно в
результате столкновения и одновременного
возбуждения молекул. Образовавшиеся
радикалы взаимодействуют с исходными
молекулами так, что в каждом элементарном
акте взамен одного радикала получается
новый. Продукт реакции накапливается
в результате многократного повторения
последовательности одних и тех же
реакций. Длина такой реакционной цепи
может достигать десятков и сотен тысяч.

Рис.4
Этапы развития цепных реакций
без
разветвления и с разветвлением цепи.
В реакциях с участием многовалентных атомов наблюдается лавинообразное увеличение числа радикалов по ходу реакции, происходит разветвление цепи. Но в обоих случаях (рис.4) по мере расходования молекул исходных веществ все более вероятными становятся столкновения радикалов друг с другом (обрывы цепи). Но в таких событиях обязательно требуется участие третьей частицы, которая должна поглотить часть энергии, выделяющейся при образовании химической связи.
Еще одним классом сложных реакций являются сопряженные реакции. Их характерной особенностью является то, что одна из реакций идет только в том случае, если одновременно с ней проходит другая, т.е. вторая реакция вызывает (индуцирует) протекание первой. Этот эффект объясняется тем, что промежуточные продукты второй реакции являются фактическими реагентами для первой. Один из примеров таких реакций разобран в теме ''Термодинамика'' (стр. 25). Кроме того можно отметить, что пероксид водорода Н2О2 в разбавленных водных растворах малоактивен в отношении ряда восстановителей (индиго, S2O32-, I-). Соответствующие реакции заметно ускоряются в присутствии катализаторов разложения перекиси (PbO2, Fe2+ и др.): наряду с собственно разложением начинается и реакция с восстановителем.
Очень распространенным типом сложных реакций являются противоположно направленные, обратимые реакции. Так называют реакции, в которых наряду с превращением исходных веществ в продукты протекает с заметной скоростью противоположно направленная реакция превращения продуктов в исходные вещества. Их особенности будут подробно обсуждаться в разделе 3.4.
