
3.3 Зависимость скорости реакции
ОТ ТЕМПЕРАТУРЫ.
Скорость химических реакций сильно зависит от температуры. В соответствии с эмпирическим правилом Вант-Гоффа (1884 г.) при повышении температуры на каждые 10 ˚С скорость многих реакций возрастает в 2 – 4 раза. Математически эта зависимость может быть выражена следующим образом:
 ,
(8)
,
(8)
где γ – температурный коэффициент скорости реакции. Смысл этой величины легко можно определить, если рассмотреть частный случай: t2 – t1 = 10 ˚C. В этом случае получаем
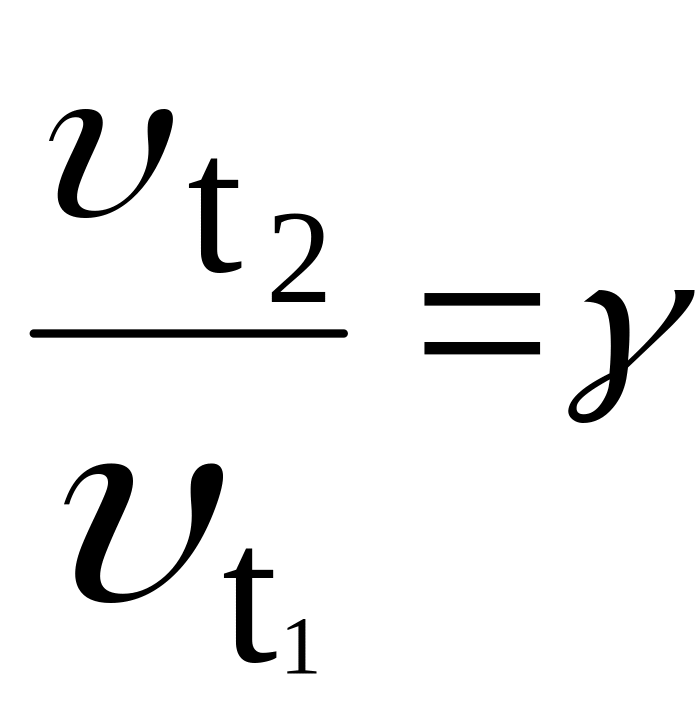 ,
,
т.е. γ показывает во сколько раз увеличивается скорость реакции при повышении температуры на 10 ºС. В соответствии с формулировкой правила Вант–Гоффа обычно температурный коэффициент принимает значения в интервале от 2 до 4.
Поскольку ранее (стр. 17, 18) при анализе выражения (3.3) было показано, что влияние температуры на скорость реакции в рамках кинетического уравнения объясняется температурной зависимостью константы скорости реакции, равенство (3.5) можно записать иначе:
 или
или
 .
.
Если задуматься над вопросом, что является причиной зависимости скорости реакции от температуры на микроскопическом уровне, то на первый взгляд может показаться, что она обусловлена увеличением числа столкновений реагирующих частиц. Однако, как показывает расчет на основе молекулярно-кинетической теории, число соударений с изменением температуры меняется незначительно (при повышении температуры на каждые 10 °С число столкновений растет в среднем всего лишь на 1–2%, а скорость при этом, как правило, увеличивается в 2–4 раза, т.е. на 100–300%). Еще одним примером, подтверждающим, что сама по себе теория столкновений не объясняет кинетические закономерности реакций, является тот факт, что в 1мл газовой смеси при комнатных температурах и общем давлении 1атм., число молекулярных соударений достигает порядка 1028. Это означает, что в таких условиях все реакции должны были бы проходить практически мгновенно. Так, например, реакция прямого синтеза иодоводорода заканчивалась бы за ~10–10 сек. В действительности же скорость взаимодействия H2 с I2 в 1014 раз меньше. Отсюда можно сделать вывод, что далеко не каждое соударение приводит к химическому взаимодействию. Для этого молекулы обязательно должны обладать определенным запасом энергии, достаточным, чтобы осуществить перераспределение электронной плотности, ослабить и разорвать связи в молекулах исходных веществ10. Этапы, которые проходит система в процессе взаимодействия с точки зрения перераспределения связей, перегруппировки атомов принято показывать с помощью энергетических диаграмм. Рассмотрим в качестве примера синтез иодоводорода из простых веществ (рис.5). Еще на рис.1 (стр.2) было показано, что при 300 ºС и парциальных давлениях реагентов 1атм. эта реакция не имеет термодинамических проблем: ΔH = –17 кДж, ΔS = 0.283 кДж/К, ΔG = –179.2 кДж. Однако, как показано несколькими строками выше, реально развивается она достаточно медленно. Главная причина состоит в том, что, несмотря на безусловную выгодность конечного состояния на пути реакциии все же возникают
энергетические
(энтальпийные) барьеры. Если задумывать
над способами п ерегруппировки
атомов, то неизбежно кроме начального
и конечного состояния потребуется
ввести понятие о промежу-точном состоянии,
энергия (энтальпия) которого макси-мальна.
Та
дополнительная энергия, которую должны
накопить молекулы реаген-тов, чтобы
преодолеть имеющийся энергетический
ерегруппировки
атомов, то неизбежно кроме начального
и конечного состояния потребуется
ввести понятие о промежу-точном состоянии,
энергия (энтальпия) которого макси-мальна.
Та
дополнительная энергия, которую должны
накопить молекулы реаген-тов, чтобы
преодолеть имеющийся энергетический
Рис.5 Энергетическая
диаграмма реакции синтеза
иодоводорода.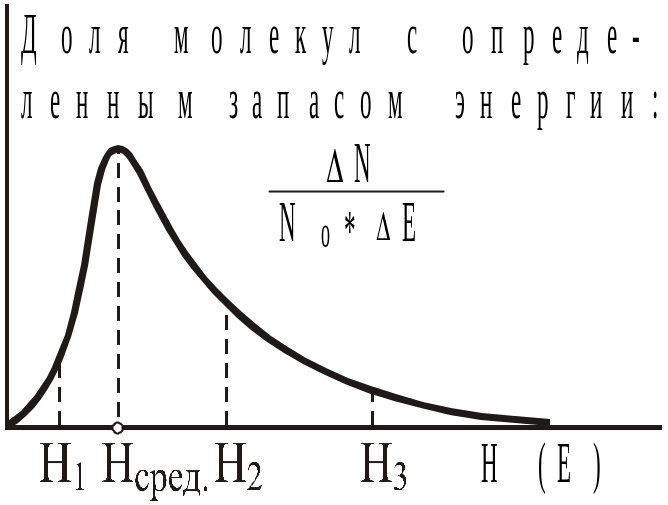 труктуре
которого связи, соответствующие реагентам
еще сохраняются, но уже ослаблены, и
одновременно начинают устанавливаться
связи, характерные для продукта реакции,
называется
активным
комплексом.
Активные комплексы существуют ничтожно
малый промежуток времени (~10–12
сек.). Их невозможно выделить, накопить
как самостоятельный продукт. Обычно их
структура определяется с помощью
квантовомеханических расчетов.
труктуре
которого связи, соответствующие реагентам
еще сохраняются, но уже ослаблены, и
одновременно начинают устанавливаться
связи, характерные для продукта реакции,
называется
активным
комплексом.
Активные комплексы существуют ничтожно
малый промежуток времени (~10–12
сек.). Их невозможно выделить, накопить
как самостоятельный продукт. Обычно их
структура определяется с помощью
квантовомеханических расчетов.
Рис.6
График распределе-ния энергии по
молекулам Больцмана-Максвелла
 а
б
а
б
Рис.7 Сопоставление некоторых термодинамических и кинетических характеристик реакции, представляемых на энергетической диаграмме (а) и графике больцмановского распределения молекул по энергиям (б) в свете обсуждения температурной зависимости скорости химической реакции |
"целиком" участвовать в реакции не может, т.к. на пути от реагентов к продуктам имеется энергетический барьер (Рис.7а), некоторые молекулы обладают энергией, равной и превышающей энергию активного комплекса (Рис.7б). Такие молекулы не имеют энергетических проблем для взаимодействия, их называют активными. При увеличении температуры средняя энергия практически не меняется, но внутри системы происходит перераспределение энергии по молекулам: доля частиц с маленькой энергией снижается, а с высокой — растет. При этом увеличивается доля (число) активных молекул (площадь заштрихованных участков на рис.7б). Доля активных частиц, а, следовательно, и константа скорости реакции возрастает с температурой по экспоненциальному закону (уравнение Аррениуса):
![]() или
после логарифмирования
или
после логарифмирования
![]() .
.
В этих формулах: К – константа скорости, А – константа Аррениуса (предэкспоненциальный множитель), Еа – энергия активации реакции, R – универсальная газовая постоянная, Т – абсолютная температура. Формальный смысл константы Аррениуса можно выявить, приравняв показатель степени нулю (Еа равна нулю или бесконечно высока температура). Тогда получаем: К = А.
Уравнение Аррениуса гораздо точней, в гораздо большем интервале температур описывает температурную зависимость скорости реакции, чем правило Вант-Гоффа. Одновременное решение этих двух уравнений позволяет показать, что температурный коэффициент γ зависит как от температуры, так и от Еа и принимает значения от 2 до 4 вблизи комнатных температур для реакций, энергия активации которых лежит в интервале ~85–170 кДж/моль. Эти условия довольно часто выполняются в газовой фазе. Многие реакции в растворах имеют очень низкие энергии активации (в среде полярного растворителя происходит ослабление и даже разрыв связей в реагентах), такие реакции нередко завершаются практически мгновенно. В то же время твердофазные реакции имеют очень высокие Еа, а, соответственно, и более высокие значения γ.
