
3 Влияние внутренних и внешних факторов
НА СКОРОСТЬ РЕАКЦИЙ
Скорость реакции зависит от многих причин. На нее влияют в первую очередь природа реагентов и продуктов (особенно в гетерогенных реакциях). Скорость взаимодействия можно изменить, поменяв концентрации реагентов в растворе или парциальные давления компонентов в газовой фазе. Очень сильно скорость химических реакций зависит от температуры. Заметно повлиять на нее могут также облучение, а также в случае гетерогенных реакций – механическая обработка и изменение площади поверхности соприкосновения реагентов. Скорость взаимодействия рассматриваемых веществ может резко измениться в присутствии дополнительных веществ (инициаторы, катализаторы, растворители, среда в растворах, вещества, вступающие в сопряженные реакции). Этот перечень, в принципе, может быть и продолжен…
3.1 Влияние природы реагентов
И ПРОДУКТОВ
Строение веществ очень многопланово сказывается на скоростях реакций. В первую очередь следует отметить, что от природы веществ зависит будет ли реакция гомогенной или гетерогенной. Гомогенные имеют большие кинетические перспективы, т.к. в этом случае реагенты контактируют во всем объеме газовой смеси или жидкого раствора. Однако и в этом случае, если активность веществ низкая, то признаков взаимодействия может не наблюдаться. Например, азот с кислородом начинают взаимодействовать с заметной скоростью только при температурах более 2000 ˚С:

Эндотермичность реакции приводит к тому, что протекает она только при постоянном поддержании соответствующей температуры.
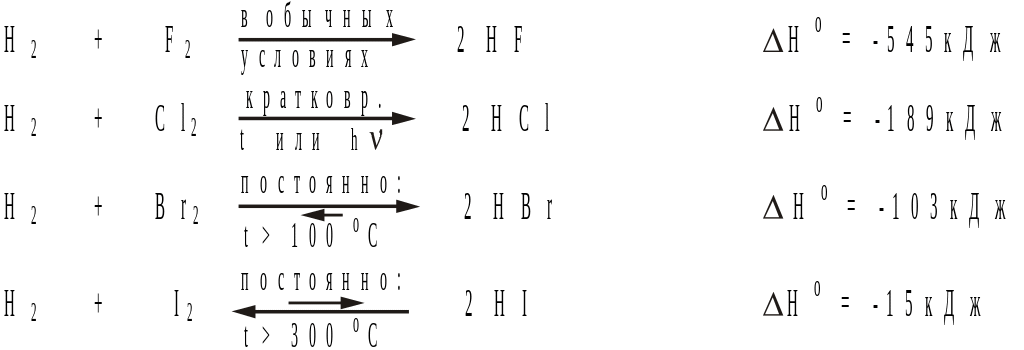 Зависимость
скорости реакции от активности реагентов
и тепловых эффектов реакций можно
наблюдать на примере взаимодействия
водорода с галогенами:
Зависимость
скорости реакции от активности реагентов
и тепловых эффектов реакций можно
наблюдать на примере взаимодействия
водорода с галогенами:
Как видно, кинетическая активность галогенов по подгруппе уменьшается. Главная причина этого состоит в усилении межмолекулярного взаимодействия, что приводит к изменению агрегатного состояния (в обычных условиях бром – жидкость, а иод – кристаллическое вещество). Кроме того уменьшается устойчивость продуктов, как следствие, уменьшается экзотермический эффект реакций, поэтому, условия, необходимые для взаимодействия не могут поддерживаться за счет теплового эффекта.
В подгруппах s – металлов активность, наоборот, увеличивается (растет длина связей в кристаллах, падает степень ее ковалентности). Последствия этого легко наблюдать на примере взаимодействия металлов с водой:
2 Ме + 2 Н2О = 2 МеОН + Н2.
Литий реагирует спокойно, натрий – энергично, калий – бурно, со вспышками и хлопками (результат возгорания на воздухе выделяющегося водорода), а цезий даже с твердой водой взаимодействует со взрывом.
В периодах активность металлов наоборот уменьшается (растущая энергия связей подтверждается изменением температур плавления: Тпл(Na) ≈ 97.9 ºC, Тпл(Mg) ≈ 650 ºС, Тпл(Al) ≈ 660 ºC):
2 Na + 2 Н2О = 2 NaОН + Н2 : активное газовыделение
в обычных условиях
Мg + 2 Н2О = Мg(ОН)2 + Н2: очень медленное взаимодействие
при нагревании.
2 Al + 6 Н2О ≠ 2 Al(ОН)3 + 3 Н2: реакция не проходит даже
с кипящей водой.
Однако следует иметь в виду, что отношение магния и алюминия к воде объясняется, в первую очередь, наличием прочных оксидных пленок. Например, после обработки поверхности алюминия ртутью (амальгамирование алюминия) уже в обычных условиях легко наблюдаются признаки взаимодействия:
2 AlHg + 6 Н2О ≠ 2 Al(ОН)3 ↓ + 3 Н2 ↑.
Еще легче магний и алюминий реагируют с растворами кислот, т.к. ион Н+ (строго говоря, ион гидроксония Н3О+ или Н+·ОН2) и термодинамически, и кинетически более активный окислитель, чем молекула воды, в составе которой приходится разрывать прочную связь Н–О:
Мg + 2 Н2О = Мg(ОН)2 + Н2: в обычных условиях
реакция не идет.
Мg + Н2SО4 (р-р) = МgSО4 (р-р) + Н2 бурное
Мg + 2 H+aq = Mg2+aq + H2 газовыделение.
Поучительным примером влияния природы продукта на скорость гетерогенной реакции может служить отношение активированного угля и кремния к кислороду воздуха (графит и алмаз – важнейшие аллотропные формы углерода сгорают только в чистом кислороде):
Сакт + О2 = СО2 (г) Si + O2 = SiO2 (тв).
Реакция с кремнием начинается при более низкой температуре (400–500 ºС против 600–700 ºС для реакции с активной модификацией углерода), но завершить ее во всем объеме удается только при сильном нагревании, т.к. продукт реакции накапливается на поверхности и затрудняет контакт реагентов. Для гарантированного окисления кремния необходимо иметь его мелкоизмельченным на момент начала реакции, а сам обжиг желательно проводить в несколько стадий с тщательным перетиранием продуктов прокаливания.
Количественный учет влияния природы реагентов и продуктов на скорость химической реакции возможен с помощью уравнения Аррениуса
(см. в разделе 3.3).
