
- •Кафедра физической и коллоидной химии
- •Учебно-целевая программа раздела
- •Знания, умения, навыки, которые должен приобрести студент.
- •Занятие № 1. Сталагмометрическое определение поверхностного натяжения водных растворов поверхностно-активных веществ (пав) и расчет размеров их молекул. План-конспект теоретической самоподготовки
- •Поверхностное натяжение.
- •Поверхностно-активные вещества
- •Свойства поверхностно-активных веществ
- •Сталагмометрическое определение поверхностного натяжения водных растворов пав.
- •Вопросы для самопроверки
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Занятие № 2. Определение критической концентрации мицеллообразования поверхностно-активных веществ с использованием метода наибольшего давления пузырьков воздуха (по Ребиндеру).
- •2.1. Мицеллообразование. Критическая концентрация мицеллообразования.
- •2.2. Способы определения критической концентрации мицеллообразования. Свойства мицеллярных растворов.
- •Вопросы для самопроверки
- •Занятие № 3. Адсорбция. Изучение адсорбции поверхностно-активных веществ на твердых сорбентах. План-конспект теоретической самоподготовки
- •3.1. Когезия. Адгезия. Растекание. Смачивание.
- •Гидрофилизация гидрофобизация
- •3.2. Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •3.3. Особенности адсорбции на границе раздела фаз твердое тело – жидкость. Экспериментальное определение адсорбции.
- •3.4. Адсорбция ионов из водных растворов электролитов.
- •3.5. Хроматография. Хроматографические методы.
- •Вопросы для самопроверки
- •Рекомендуемая литература: Основная
- •Дополнительная
- •Содержание
- •Для записей
- •357532, Г. Пятигорск, пр. Калинина, 11.
3.3. Особенности адсорбции на границе раздела фаз твердое тело – жидкость. Экспериментальное определение адсорбции.
Адсорбция из растворов на твердых адсорбентах имеет свои особенности: адсорбционное равновесие устанавливается медленно; большие затраты энергии адсорбатом на вытеснение с поверхности адсорбента молекул растворителя, связанных с ним адгезионными силами.
При адсорбции из раствора молекул поверхностно-активных веществ на поверхности адсорбента они ориентируются так, чтобы полярная часть дифильной молекулы была обращена к полярной фазе (рис. 19, а), а неполярная часть – к неполярной (рис. 19, б).
бензол вода

/ / / / / / / / / / / / / / / / / / / / / /
силикагель уголь
Рис. 19.
а) б)
Чем хуже растворитель смачивает поверхность адсорбента и чем хуже растворяет вещество, тем лучше будет происходить адсорбция растворенного вещества.
Правило уравнивания полярностей (П.А. Ребиндер): вещество (С) может адсорбироваться на поверхности раздела фаз (А и В), если при адсорбции будет уравниваться полярность этих фаз, т.е. полярность вещества должна быть промежуточной между веществами, составляющими фазы: А С В или А С В, где - диэлектрическая проницаемость.
Адсорбционная способность вещества зависит от ряда факторов:
чем больше молярная масса вещества, тем больше его адсорбируемость;
ароматические соединения адсорбируются лучше, чем алифатические с такой же или близкой молярной массой, а непредельные – лучше, чем насыщенные;
чем ниже температура, тем больше адсорбируемость вещества, т.к. процесс адсорбции сопровождается выделением тепла (экзотермический).
Экспериментально величину адсорбции (А) на границе твердое тело – жидкость рассчитывают по уравнению:
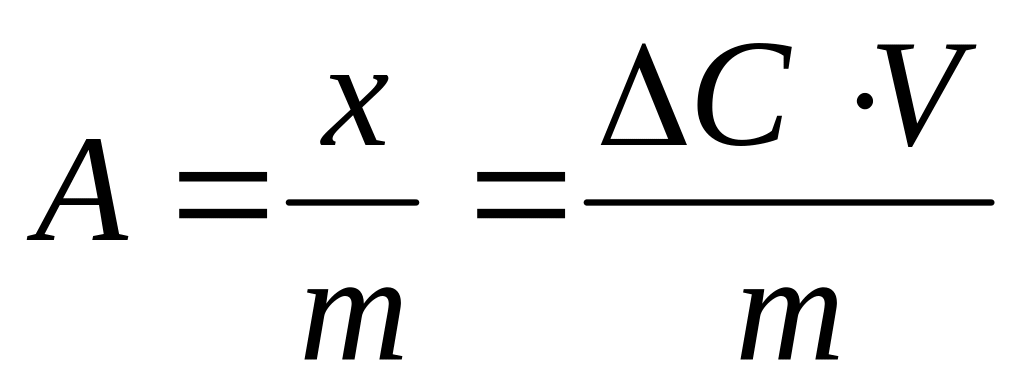 ,
где
,
где
С – разность между начальной и равновесной концентрацией вещества в растворе (моль/л);
V – объем раствора (л);
m – масса адсорбента (кг).
Практическое значение адсорбции огромно: очистка растворов от примесей; осветление сиропов, настоек, соков, вин; извлечение малых количеств веществ, растворенных в больших объемах жидкости (технология редких элементов); адсорбционная хроматография (технология витаминов, пигментов, очистка лекарственных веществ, воды и др.)
3.4. Адсорбция ионов из водных растворов электролитов.
Сильные электролиты адсорбируются в виде ионов. Ионная адсорбция имеет ряд особенностей:
скорость ионной адсорбции меньше скорости молекулярной адсорбции;
ионная адсорбция не всегда обратима, т.к. может сопровождаться хемосорбцией;
при ионной адсорбции на поверхности адсорбента возникает определенный заряд, который притягивает из раствора противоположно заряженные ионы, в результате на границе раздела фаз возникает двойной электрический слой;
адсорбируемость ионов определяется величиной их заряда, радиусом и степенью сольватации;
при равенстве заряда лучше адсорбируются ионы с большим радиусом, т.к. они менее сольватированы;
по величине адсорбции ионы располагаются в лиотропные ряды, которые для водных систем выглядят так:


увеличение адсорбируемости
катионы: Li+ Na+ K+ Pb+ Cs+
анионы: F - Cl - Br - NO3- I - CNS -

увеличение степени гидратированности
многозарядные ионы адсорбируются лучше однозарядных. Исключение составляет катион водорода, обладающий наибольшей адсорбционной способностью.
Na+ K+ NH4+ Mg2+ Ca2+ Ba2+ Al3+ Fe3+ H +
увеличение адсорбции
если в растворе электролитов имеются такие же ионы, как и в составе твердого адсорбента, то ионная адсорбция принимает строго избирательный характер, описываемый правилом Панета-Фаянса.
Правило Панета – Фаянса: на поверхности кристалла преимущественно адсорбируются те ионы, которые входят в состав кристаллической решетки адсорбента и могут ее достроить.
Ионообменная адсорбция – это явление эквивалентного обмена собственных ионов нерастворимого адсорбента, посылаемых в раствор, на другие ионы того же знака, находящиеся в растворе.
Адсорбенты, способные к обмену ионов с раствором, называются ионитами или ионообменниками.
Классификация ионитов: 1) по происхождению: природные (глауконит, гумусовые вещества почв) и искусственные (пермутиты – алюмосиликаты, синтетические ионообменные смолы);
2) по кислотно-основным свойствам – катиониты (вещества кислотного типа, обменивающиеся катионами) и аниониты (вещества основного типа, обменивающиеся анионами); амфотерные иониты (амфолиты), содержащие и катионные и анионные обмениваемые группы.
Ионообменные смолы – это высокомолекулярные нерастворимые соединения, способные к набуханию в воде и к высвобождению ионов в процессе электролитической диссоциации.
Обменная емкость – способность ионита обменивать противоионы. Она определяется числом молей (или миллимолей) извлекаемых из раствора ионов в расчете на единицу массы сухого ионита.
Ионообменная адсорбция используется в медицинской практике для очистки воды, консервирования крови (удаление катионов Са2+), беззондовой диагностики кислотности желудочного сока, детоксикации организма при различных отравлениях, нормализации ионного баланса в организме. В фармации иониты используют для аналитических целей – извлечение из смеси анализируемого вещества. В агротехнике, при выращивании лекарственных растений – для улучшения структуры почв.
Умягчения жесткой воды проводят путем пропускания воды через катионит, (например КУ-1, КУ-2) в Na-форме:

 SO3Na
SO3
SO3Na
SO3
к

 атионит
+
Са 2+
+ 2Cl -
катионит
Ca + 2Na+
+
2Cl
-
атионит
+
Са 2+
+ 2Cl -
катионит
Ca + 2Na+
+
2Cl
-
SO3Na SO3
Обессоливание воды (деминерализацию) проводят путем последовательного пропускания ее через катионит в Н-форме и анионит (например, АН-1) в ОН-форме
к атионит
- SO3H
+ Na+
+
Cl -
катионит
- SO3Na
+ H+
+
Cl -
атионит
- SO3H
+ Na+
+
Cl -
катионит
- SO3Na
+ H+
+
Cl -
а нионит - NH3OH + H+ + Cl - катионит - NH3Cl - + H2O
Регенерация ионитов – восстановление первоначального состояния ионита. Для перевода в Н-форму катионит обрабатывается концентрированными растворами кислот, регенерация анионита в ОН-форму осуществляется выдерживанием в растворах NaOH.
