
- •Кафедра физической и коллоидной химии
- •Учебно-целевая программа раздела
- •Знания, умения, навыки, которые должен приобрести студент.
- •Занятие № 1. Сталагмометрическое определение поверхностного натяжения водных растворов поверхностно-активных веществ (пав) и расчет размеров их молекул. План-конспект теоретической самоподготовки
- •Поверхностное натяжение.
- •Поверхностно-активные вещества
- •Свойства поверхностно-активных веществ
- •Сталагмометрическое определение поверхностного натяжения водных растворов пав.
- •Вопросы для самопроверки
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Занятие № 2. Определение критической концентрации мицеллообразования поверхностно-активных веществ с использованием метода наибольшего давления пузырьков воздуха (по Ребиндеру).
- •2.1. Мицеллообразование. Критическая концентрация мицеллообразования.
- •2.2. Способы определения критической концентрации мицеллообразования. Свойства мицеллярных растворов.
- •Вопросы для самопроверки
- •Занятие № 3. Адсорбция. Изучение адсорбции поверхностно-активных веществ на твердых сорбентах. План-конспект теоретической самоподготовки
- •3.1. Когезия. Адгезия. Растекание. Смачивание.
- •Гидрофилизация гидрофобизация
- •3.2. Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •3.3. Особенности адсорбции на границе раздела фаз твердое тело – жидкость. Экспериментальное определение адсорбции.
- •3.4. Адсорбция ионов из водных растворов электролитов.
- •3.5. Хроматография. Хроматографические методы.
- •Вопросы для самопроверки
- •Рекомендуемая литература: Основная
- •Дополнительная
- •Содержание
- •Для записей
- •357532, Г. Пятигорск, пр. Калинина, 11.
Поверхностно-активные вещества
Поверхностно-активными веществами (ПАВ) называются вещества, адсорбирующиеся на поверхности раздела фаз и снижающие межфазное поверхностное натяжение.
ПАВ относительно воды являются многие органические соединения (жирные кислоты и их соли, сульфокислоты и их соли, спирты, амины).
Молекулы ПАВ имеют дифильное строение, т.к. содержат одновременно полярные (гидрофильные) и неполярные (олеофильные) функциональные группы.
Д

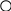 ифильные
молекулы ПАВ изображаются символом:
,
где 1 –
полярная группа, 2 – неполярный радикал.
ифильные
молекулы ПАВ изображаются символом:
,
где 1 –
полярная группа, 2 – неполярный радикал.В фармации ПАВ используют как:
стабилизаторы лекарственных форм (эмульсий, суспензий, пен);
солюбилизаторы, повышающие растворимость трудно растворимых веществ;
медицинские и косметические мыла;
лекарственные и биологически активные вещества (например, алкалоиды, танниды, полисахариды, сульфаниламиды, антибиотики и др.).
ПАВ классифицируют по различным признакам:
а) по размерам молекул:
высокомолекулярные (белки, полипептиды, полисахариды);
низкомолекулярные (спирты, фенолы, амины, кетоны)
б) по способности к ионизации:
- неионогенные (спирты, эфиры, кетоны, твины и др.);
- ионогенные: - анионактивные (карбоновые кислоты алифатического и ароматического рядов и их соли; сульфокислоты и их соли, фенолы и др.);
- катионактивные (амины, соли четвертичных аммониевых оснований, алкалоиды);
- амфотерные (аминокислоты, белки, полипептиды)
Амфотерные ПАВ способны диссоциировать в зависимости от рН среды: в кислой они катионактивны, в щелочной – анионактивны.
в) по поведению в растворах:
истинно-растворимые (спирты, эфиры, кетоны, низшие алифатические кислоты и их соли);
мицеллообразующие (коллоидно-растворимые, МПАВ, танниды, органические красители)
г) по назначению:
моющие средства (медицинские, парфюмерные, косметические мыла, шампуни, порошки);
солюбилизаторы;
стабилизаторы дисперсных систем;
смачиватели;
гелеобразователи;
фармакологические средства (лекарственные и биологически-активные вещества).
Свойства поверхностно-активных веществ
На поверхности раздела фаз молекулы ПАВ ориентируются гидрофильной группой в сторону полярной фазы, олеофильной – в сторону неполярной.
Из-за малого сродства к молекулам растворителя молекулы ПАВ выталкиваются из раствора на межфазные границы: поверхность раствора, стенки сосудов, поверхность частиц дисперсной фазы и др., снижая при этом поверхностное натяжение.
Графическая зависимость, характеризующая изменение поверхностного натяжения раствора ПАВ с изменением его концентрации, называется изотермой поверхностного натяжения (рис. 2).

1
2
3
 С
С
Рис. 2
Участок изотермы 1, с крутым наклоном, соответствует малым концентрациям ПАВ, при котором их число на поверхности невелико и они могут свободно по ней перемещаться, практически не мешая друг другу. Такое состояние молекул ПАВ на поверхности может быть названо «двухмерным газом».
Криволинейный участок изотермы 2, соответствует средним концентрациям ПАВ, когда часть поверхности занята ПАВ, что снижает их дальнейшую адсорбцию.
Участок изотермы 3 соответствует большим концентрациям ПАВ, когда практически вся поверхность раствора занята монослоем из дифильных молекул. При этом величина их адсорбции, а следовательно, и поверхностное натяжение не увеличивается с ростом концентрации.
Молекулы ПАВ на границе «водный раствор-газ» образуют адсорбционный слой толщиной в одну молекулу – мономолекулярный слой (рис. 3 в)
воздух

вода
а) б) в)
Рис.3
В зависимости от концентрации раствора расположение в мономолекулярном слое молекул ПАВ, будет различным.
При низких концентрациях ПАВ в адсорбционном слое гибкий углеводородный радикал лежит на поверхности воды (рис. 3 а). С увеличением концентрации раствора ПАВ углеводородные радикалы ориентируются параллельно друг другу и перпендикулярно поверхности воды (рис. 3 б,в).
Когда вся поверхность раствора покрывается мономолекулярным слоем вертикально ориентированных молекул ПАВ образуется «частокол Ленгмюра», названный в честь И. Ленгмюра (рис. 3в).
Взаимосвязь между поверхностным избытком адсорбированного ПАВ (Г), концентрацией (С) и поверхностным натяжением () описывается уравнением адсорбции Гиббса: Г
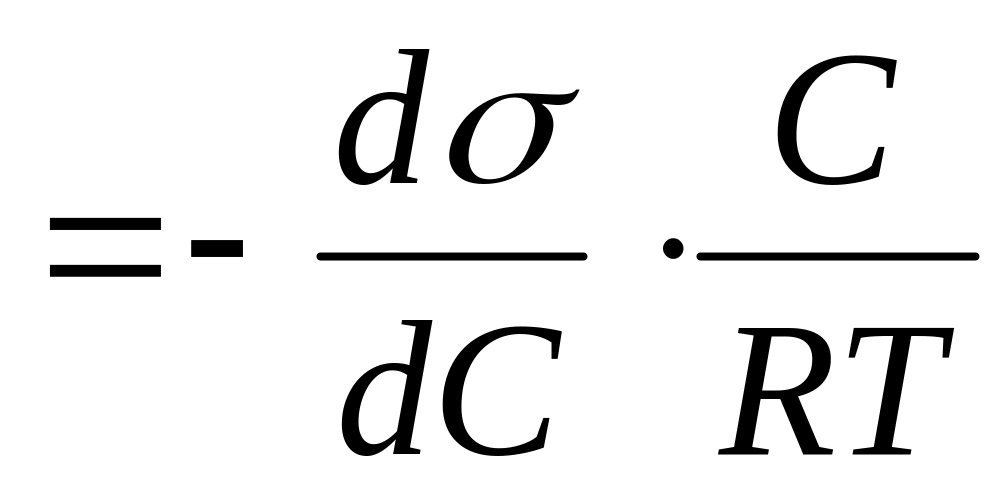
Д
 ля
практических вычислений используют
интегральную форму уравнения:
ля
практических вычислений используют
интегральную форму уравнения:
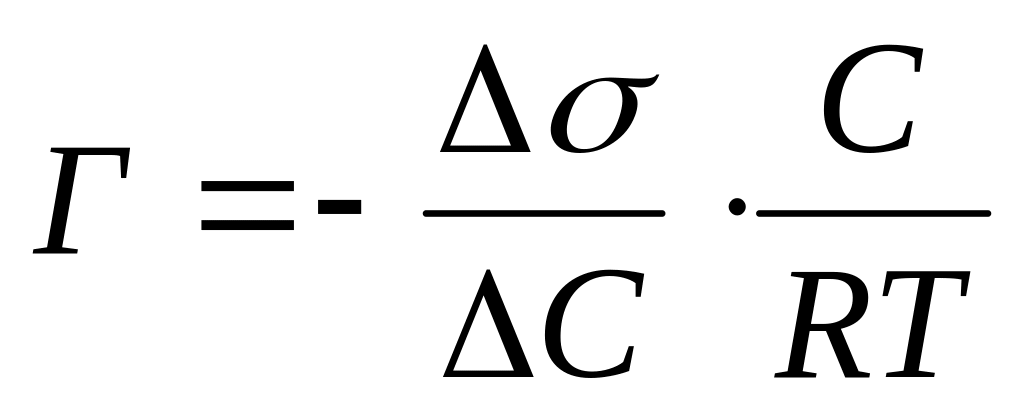 , где
, где
- изменение поверхностного натяжение раствора по сравнению с водой;
С - изменение концентрации раствора ПАВ по сравнению с ближайшим в сторону уменьшения раствором ПАВ;
Т - температура выраженная в Кельвинах;
R - универсальная газовая постоянная
Величина
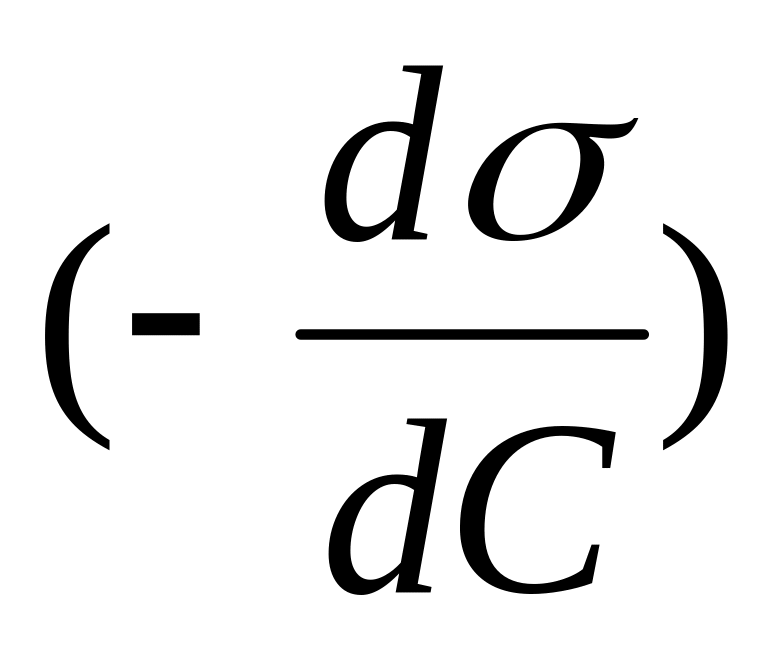 называется
поверхностной
активностью. Она
служит мерой способности ПАВ снижать
поверхностное натяжение. Знак минус
говорит о том, что с увеличением
концентрации ПАВ в растворе его
поверхностное натяжение уменьшается.
называется
поверхностной
активностью. Она
служит мерой способности ПАВ снижать
поверхностное натяжение. Знак минус
говорит о том, что с увеличением
концентрации ПАВ в растворе его
поверхностное натяжение уменьшается.Из уравнения Гиббса следует, что если


0, то Г
0 – концентрация растворимого вещества
в поверхностном слое меньше, чем в
объеме (отрицательная
адсорбция).
Это наблюдается в растворах
поверхностно-инактивных веществ.
0, то Г
0 – концентрация растворимого вещества
в поверхностном слое меньше, чем в
объеме (отрицательная
адсорбция).
Это наблюдается в растворах
поверхностно-инактивных веществ.Если концентрация растворимого вещества в поверхностном слое больше, чем в объеме раствора, т.е. Г 0, то 0 (положительная адсорбция). Это наблюдается в растворах поверхностно-активных веществ.
Величину поверхностной активности при концентрации ПАВ, стремящейся к нулю, можно определить графически, используя касательную проведенную через точку, соответствующую растворителя к практически прямолинейному участку изотермы поверхностного натяжения (рис. 4)

А

О В С
Рис. 4
Согласно
рис. 4 tg
=
![]()
Поверхностная активность ПАВ зависит от длины углеводородного радикала его молекулы. Эта зависимость описывается правилом Дюкло-Траубе, применимым к жирным кислотам, спиртам и другим соединениям с неразветвленной цепью.
Правило Дюкло-Траубе: поверхностная активность веществ в водных растворах с одинаковой концентрацией при увеличении углеводородного радикала на одну группу -СН2- возрастает в 3 – 3,5 раза.
Для органических сред правило Дюкло-Траубе обращается: увеличение длины углеводородного радикала на группу -СН2- приводит к снижению поверхностной активности в 3 – 3,5 раза.
Изотермы поверхностного натяжения при сравнительно больших концентрациях могут быть описаны с помощью уравнения Шишковского (1908 г): = 0 - = а ln (1+ вс),
где 0, – поверхностное натяжение растворителя и раствора,
с – концентрация раствора ПАВ;
а и в – константы
Физический смысл констант а и в выяснен Ленгмюром. Константа а характерна для каждого данного гомологического ряда, в котором она одинакова для всех входящих в него веществ. Ее значение может быть рассчитано по уравнению: а = ГRT.
Константа в индивидуальна для каждого ПАВ и имеет смысл константы адсорбционного равновесия. Ее значение увеличивается с увеличением длины углеводородного радикала ПАВ.
Сродство молекул ПАВ к водной и неводной фазам оценивается величиной гидрофильно-липофильного баланса (ГЛБ).
ГЛБ – это соотношение между энергией взаимодействия гидрофильной группы молекулы ПАВ с водой и энергией взаимодействия гидрофобной группы с неполярной средой (бензолом, толуолом и т.п.).
По шкале ГЛБ, предложенной Дэвисом и Гриффином, всем известным в настоящее время ПАВ приписываются числа от 1 (ГЛБ олеиновой кислоты) до 40 (ГЛБ лаурилсульфата натрия).
Чем больше энергия взаимодействия гидрофильной группы ПАВ с водой по сравнению с энергией взаимодействия гидрофобной группы с неполярной средой, тем выше число ГЛБ.
ПАВ с ГЛБ ниже 10 используют в фармации для стабилизации эмульсий типа вода в масле (в/м), выше 10 – для эмульсий типа масло в воде (м/в).
ПАВ с ГЛБ 7 – 9 используются как смачиватели, с 12 – 16 как солюбилизаторы, с 13 – 18 как моющие средства и т.д.
