
- •Кафедра физической и коллоидной химии
- •Учебно-целевая программа раздела
- •Знания, умения, навыки, которые должен приобрести студент.
- •Занятие № 1. Сталагмометрическое определение поверхностного натяжения водных растворов поверхностно-активных веществ (пав) и расчет размеров их молекул. План-конспект теоретической самоподготовки
- •Поверхностное натяжение.
- •Поверхностно-активные вещества
- •Свойства поверхностно-активных веществ
- •Сталагмометрическое определение поверхностного натяжения водных растворов пав.
- •Вопросы для самопроверки
- •Решение типовых задач
- •Задачи для самостоятельного решения
- •Занятие № 2. Определение критической концентрации мицеллообразования поверхностно-активных веществ с использованием метода наибольшего давления пузырьков воздуха (по Ребиндеру).
- •2.1. Мицеллообразование. Критическая концентрация мицеллообразования.
- •2.2. Способы определения критической концентрации мицеллообразования. Свойства мицеллярных растворов.
- •Вопросы для самопроверки
- •Занятие № 3. Адсорбция. Изучение адсорбции поверхностно-активных веществ на твердых сорбентах. План-конспект теоретической самоподготовки
- •3.1. Когезия. Адгезия. Растекание. Смачивание.
- •Гидрофилизация гидрофобизация
- •3.2. Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха.
- •3.3. Особенности адсорбции на границе раздела фаз твердое тело – жидкость. Экспериментальное определение адсорбции.
- •3.4. Адсорбция ионов из водных растворов электролитов.
- •3.5. Хроматография. Хроматографические методы.
- •Вопросы для самопроверки
- •Рекомендуемая литература: Основная
- •Дополнительная
- •Содержание
- •Для записей
- •357532, Г. Пятигорск, пр. Калинина, 11.
Гидрофилизация гидрофобизация
Рис. 11.
а) адсорбционный слой ПАВ на гидрофобной поверхности
б) адсорбционный слой ПАВ на гидрофильной поверхности
Инверсия смачивания широко используется в текстильной технологии (окраска, пропитка и др.), в фармацевтической технологии при производстве композиционных лекарственных форм, при стирке, флотации и др.
3.2. Адсорбция. Виды адсорбции. Уравнения Ленгмюра и Фрейндлиха.
Адсорбция – концентрирование вещества из объема фаз на поверхности раздела между ними. Адсорбция может рассматриваться как поглощение вещества (адсорбата) поверхностью адсорбента.
Адсорбент – вещество, на поверхности которого протекает адсорбция.
Адсорбтив – газ или растворенное вещество, способное адсорбироваться на поверхности адсорбента.
Адсорбат – адсорбированное вещество, находящееся на поверхности адсорбента. Часто понятия «адсорбтив» «адсорбат» отождествляются
Различают физическую адсорбцию, происходящую без химического изменения адсорбата и химическую адсорбцию (хемосорбцию), сопровождающуюся химическим взаимодействием адсорбтива с адсорбентом.
Адсорбция бывает на границах раздела фаз: твердое тело – жидкость, твердое тело – газ, жидкость – газ, жидкость – жидкость.
Если вещество адсорбируется в виде молекул, говорят о молекулярной адсорбции, в виде ионов – ионной адсорбции.
Адсорбция – обратима, обратный процесс называют десорбцией.
Скорости адсорбции и десорбции равны между собой при адсорбционном равновесии, которому соответствует равновесная концентрация адсорбата в растворе или равновесное давление в газовой фазе.
Величина адсорбции (А) характеризуется равновесным количеством поглощаемого вещества (Х), приходящимся на единицу массы твердого адсорбента (m):
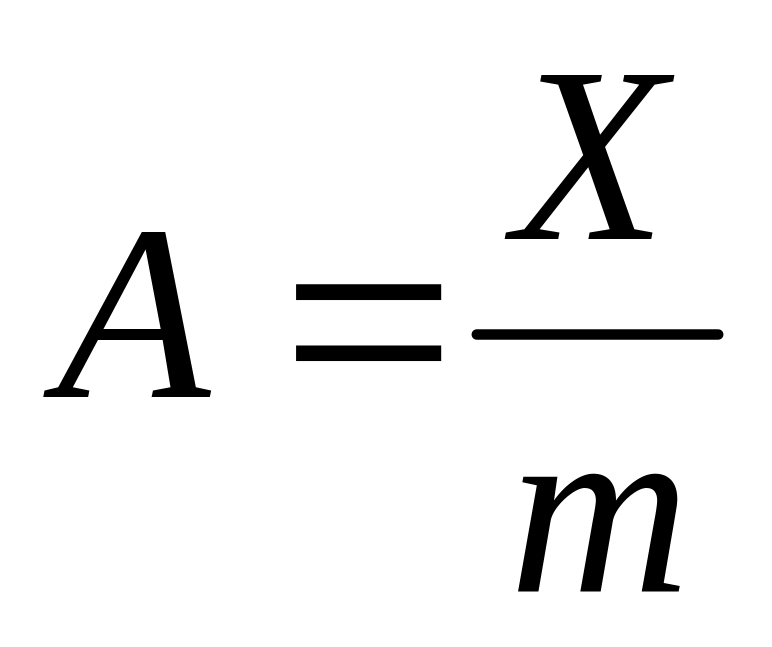 [моль/кг или кг/кг]
[моль/кг или кг/кг]
Изотерма адсорбции – графическое отображение зависимости величины адсорбции от равновесной концентрации или равновесного давления при данной постоянной температуре.
Различают адсорбцию мономолекулярную, при которой адсорбат покрывает поверхность адсорбента слоем толщиной в одну молекулу и полимолекулярную, при которой молекулы адсорбата могут располагаться на поверхности адсорбента в несколько слоев.
Изотерма мономолекулярной адсорбции имеет вид, изображенный на рис. 12 (изотерма Ленгмюра)
А
 Участок I
– отвечает малым
равновесным концентрациям (давлениям),
когда небольшая часть поверхности
адсорбента занята молекулами адсорбата,
а зависимость А – с (р) линейна;
Участок I
– отвечает малым
равновесным концентрациям (давлениям),
когда небольшая часть поверхности
адсорбента занята молекулами адсорбата,
а зависимость А – с (р) линейна;
А


 Участок
II
– средним
концентрациям (давлениям) при которых
значительная доля поверхности адсорбента
занята молекулами адсорбата;
Участок
II
– средним
концентрациям (давлениям) при которых
значительная доля поверхности адсорбента
занята молекулами адсорбата;
I II III c (р) Участок III – наблюдается при высоких равновес-
ных концентрациях (давлениях), когда вся поверхность адсорбента занята молекулами адсорбата и достигнута предельная величина адсорбции (А).
Изотерма мономолекулярной адсорбции хорошо описывается уравнением Ленгмюра:
![]() или
или
![]()
где в, А константы, индивидуальные для каждого отдельного вещества при адсорбции на конкретном адсорбенте;
с, р – равновесная концентрация или равновесное давление.
При малых равновесных концентрациях можно пренебречь величиной с или р в знаменателе. Тогда уравнение Ленгмюра преобразуется в уравнение прямой, проходящей через начало координат:
А = А в с или А =А в р
При больших равновесных концентрациях можно пренебречь в знаменателе величиной в. Тогда уравнение Ленгмюра преобразуется в уравнение прямой не зависящей от с или р: А = А
Для практических расчетов необходимо знать константы уравнения Ленгмюра А и в. Преобразование уравнения в линейную форму прямой, не проходящей через начало координат:
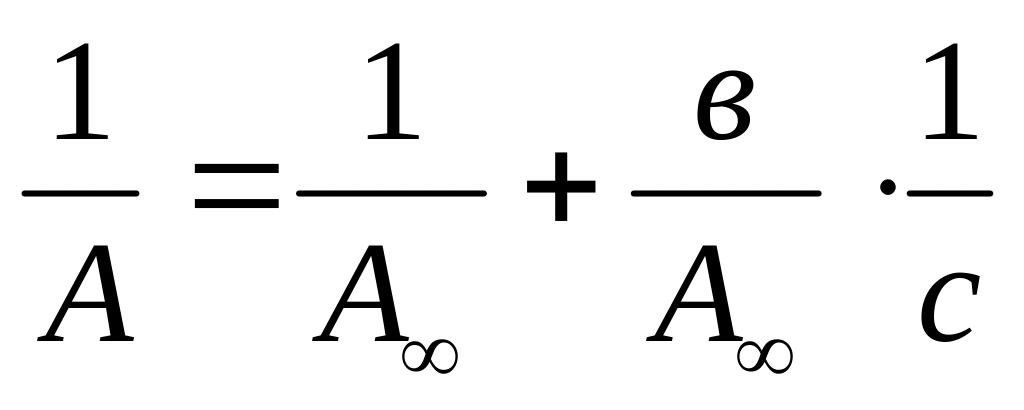 ,
позволяет строить график зависимости
1/А - 1/с (рис. 13).
,
позволяет строить график зависимости
1/А - 1/с (рис. 13).

 1/А
Отрезок ОВ равен 1/А.
Коэффициент
в можно
найти, исходя из того, что в
равен концентрации, при которой величина
адсорбции составляет половину от
предельной.
1/А
Отрезок ОВ равен 1/А.
Коэффициент
в можно
найти, исходя из того, что в
равен концентрации, при которой величина
адсорбции составляет половину от
предельной.
2/А В
1/А
О Д 1/С (1/Р)
Рис. 13.
На графике интерполяцией определяется отрезок ОД, соответствующий 2/А и равный 1/в. Тогда в = 1/ОД.
Уравнение Ленгмюра было выведено на основе теории мономолекулярной адсорбции, которая имеет следующие основные положения:
адсорбция молекул происходит только на адсорбционных центрах (вершины неровностей и узкие поры);
каждый адсорбционный центр может удерживать только одну молекулу адсорбата;
процесс адсорбции обратим; адсорбционное равновесие носит динамический характер. Адсорбированные молекулы удерживаются адсорбционными центрами только определенное время, после чего происходит десорбция этих молекул и адсорбция того же числа новых молекул.
Кроме уравнения Ленгмюра на практике часто используется уравнение Фрейндлиха:
А = КС1/n или А = КР1/n, где К и 1/n – константы эмпирические.
Уравнение более подходит для описания адсорбции на пористых или порошкообразных адсорбентах в области средних концентраций (давлений).
И
 зотерма
адсорбции Фрейндлиха не имеет
горизонтальной прямой и адсорбция с
ростом концентрации (давления)
увеличивается (рис. 14).
зотерма
адсорбции Фрейндлиха не имеет
горизонтальной прямой и адсорбция с
ростом концентрации (давления)
увеличивается (рис. 14).
А
 lg
A
N
lg
A
N
Д М

В
О
с, (р) lg с (lg р)
Рис. 14 Рис. 15
Для нахождения констант уравнения Фрейндлиха оно преобразуется с момощью логарифмирования в уравнение прямой, не проходящей через начало координат: lg А = lg К + 1/n lg С.
В
соответствии с этим график зависимости
lg
А от lg
С или (Р), построенный по экспериментальным
данным имеет вид, показанный на рис. 15.
Экстраполяцией на ось ординат получают
отрезок ОВ равный lg
К. Тангенс угла наклона прямой ВN
к оси абсцисс равен 1/n
(tg
=
![]() )
)
Полимолекулярная адсорбция – наблюдается при адсорбции на пористых или порошкообразных адсорбентах (силикагель, активированный уголь, порошки и таблетки лекарственных веществ). В этом случае адсорбция продолжается до образования плотного мономолекулярного слоя, как показано на рис. 16.
 адсорбат А
адсорбат А

адсорбент
Рис. 16. с, (р)
Рис. 17.
Такой адсорбции отвечает изотерма другого вида (рис. 17), так называемая «S – изотерма».
Капиллярная конденсация – явление сжижения пара в порах или капиллярах твердого адсорбента, она наблюдается при поглощении легко сжижающихся газов или паров (например, воды, бензола и др.) в результате полимолекулярной адсорбции. При этом полимолекулярный слой представляет собой тончайшую пленку жидкости, покрывающую внутреннюю поверхность поры. Сливающиеся друг с другом в узких местах слои такой жидкости образуют вогнутые мениски, под которыми создается пониженное давление пара. Благодаря этому поры втягивают в себя молекулы газа (пара) и заполняются жидкостью, образующейся при конденсации.
При протекании адсорбции, осложненной капиллярной конденсацией, изотерма отвечающая заполнению пор (1) не совпадает с изотермой (2), отвечающей их опорожнению (рис. 18). На изотерме образуется петля конденсационного гистерезиса. Процессы адсорбции и десорбции не совпадают.
А
р
Рис. 18.
