
- •Механіка
- •Молекулярна фізика
- •10.1. Перше начало термодинамiки. Поняття функції стану I функціоналу. Робота газу при рiзнux процесах.
- •12.1. Рівняння стану реального газу. Ізотерми реального газу.
- •Електрика та магнетизм
- •17.1. Електричне поле. Напруженість електричного поля. Теорема Остроградського-Гаусса. Різниця потенціалів. Зв’язок між напруженістю та різницею потенціалів.
- •10.2. Дифракція на багатомірних гратках. Дифракція рентгенівських променів. Методи рентгеноструктурного аналізу.
- •12.2. Закони теплового випромінювання. Індуковане випромінювання. Лазери.
- •Фізика атома і атомних явищ
- •Фізика ядра та елементарних частинок
- •10.3.Бета-розпад. Види Бетарозпаду. Енергетичнi спектри електронiв. Експерuментальний доказ iснування нейтрино.
- •11.3. Космічні промені. Первинне космічне випромінювання. Проходження космічного випромінювання крізь атмосферу.
- •Теоретична фізика
12.1. Рівняння стану реального газу. Ізотерми реального газу.
Для
отр. р-ня стану реального газу, в р-ня
стану ідеального газу введемо поправки,
що врах. дію сил притягання і відштовхування
між мол. Розглянемо 1 моль газу, який
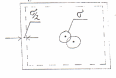
знах. в посудині кубічної форми. Нехай
ефективний діаметр мол. – σ. Мол. може
наблизитись до стінки на σ/2. Доступний
для перебування в цій посудині
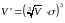
 Наявність
в V
інших мол. газу робить також недоступним
V
для знах. центру розглядуваної мол.:
Наявність
в V
інших мол. газу робить також недоступним
V
для знах. центру розглядуваної мол.:
 ,
де
,
де

В
процесі хаотичного руху мол. сфери їх
“недоступності”
в об’ємі
перекриваються, тому праву частину
виразу треба зменшити в 2 рази:
 - поправка Ван-дер-Ваальса на власний
об’єм,
тоді:
- поправка Ван-дер-Ваальса на власний
об’єм,
тоді:
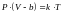
Врахуємо тепер дію сил притягання між мол. газу. Нехай сили притягання між мол. суттєві тільки на відстані R, яку наз. радіусом міжмолекулярної взаємодії.

Виділимо
біля стінки посудини шар товщиною <
2R.
Всі мол., що знах. на відстанях менших
за R
зазнають дії нескомпенсованої сили
притягання зі сторони інших мол. газу,
яка направлена від стінки посудини.
 .
Від чого залежить величина ΔP?
Очевидно, що Fрезульт.,
що діє на кожну мол. шару товщиною d
~
n0.
В свою чергу
.
Від чого залежить величина ΔP?
Очевидно, що Fрезульт.,
що діє на кожну мол. шару товщиною d
~
n0.
В свою чергу
 ,
тобто поправка на тиск ΔP
визначається сумою сил, що діють на мол.
в шарі товщиною d
біля стінки площею ΔS.
,
тобто поправка на тиск ΔP
визначається сумою сил, що діють на мол.
в шарі товщиною d
біля стінки площею ΔS.
 ,
а – постійна Ван-дер-Ваальса, що врах.
дію сил притягання між мол. реального
газу. Її значення різне для різних сортів
газу.
,
а – постійна Ван-дер-Ваальса, що врах.
дію сил притягання між мол. реального
газу. Її значення різне для різних сортів
газу.
 – рівняння Ван-дер-Ваальса для одного
моля газу. Тут входить молекулярний
об’єм
V,
який в загальному випадку:
– рівняння Ван-дер-Ваальса для одного
моля газу. Тут входить молекулярний
об’єм
V,
який в загальному випадку:
 .
Тоді
.
Тоді
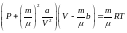 - для
к-ті газу.
- для
к-ті газу.
 .
a
і b
залежать як від сорту газу, так і від T
і V,
а тому р-ня є наближеним, бо a
і b
вважаються постійними. Це привело до
того, що крім рівняння Ван-дер-Ваальса,
існують ще інші рівняння стану реального
газу: Рівняння
Дітерічі:
.
a
і b
залежать як від сорту газу, так і від T
і V,
а тому р-ня є наближеним, бо a
і b
вважаються постійними. Це привело до
того, що крім рівняння Ван-дер-Ваальса,
існують ще інші рівняння стану реального
газу: Рівняння
Дітерічі:
 Рівняння
Клаузіуса:
Рівняння
Клаузіуса:
 .
.

Р-ня стану реального газу це р-ня 3-го степеня відносно V, а тому, якщо розгул. випадок T=const, кожному значенню P буде відповідати 3 різні значення V. Якщо побудувати залежність P(V) при T=const, то отр. ізотерму Ван-дер-Ваальса для реального газу. Якщо розглядати експерт. побудовані ізотерми реального газу (ізотерми Ендрюса), то для різних значень T вони виглядають.

Протяжність горизонтальної ділянки зменшується з ростом Т. І при деякій Т горизонтальна ділянка на ізотермі Ендрюса зникає. Цю Т наз. критичною. На представленому графіку можна виділити 4 області. В 1-ій області речовина перебуває в газоподібному стані, в 2 при кожній Т завжди має місце динамічна рівновага між рідиною та її парою, в 3 області речовина знах. в рідкому стані, в 4 області речовина знах. в критичному стані.

7.Внутрішня енергія реального газу. Зміна температури реального газу при його адіабатичному розширенні, ефект Джоуля-Томсона.
8.Вільна поверхнева енергія рідин. Додатковий тиск Лапласа. Капілярні явища.

В поверхневому шарі мол. рідини завжди діють сили які, перешкоджають збільшенню площі вільної поверхні. Ці сили напрямлені до поверхні їх наз. силами поверхневого натягу.
Із-за дії сили поверхневого натягу на рідину відбувається викривлення поверхні рідини, ств. додатковий р – р Лапласа.
Капіляром наз. трубки малих розмірів в яких форма рідини в них міститься виникає основному силами взаємодії молекул між собою та з молекулами су-мішок а недіють сили тяжіння. Ід сил тяжіня поверхня рідини в трубках є горизон-тальною при занурені капілярів в посудену з рідинами спостерігається порушення закону сполучених посуден тобто рівні води в капілярах неспівпадають з різними рідинами в посудені в випадку змочуваню в капілярі піднімається више зазначе-ного рівня а в випадку незмочуваня капіляру знаходиться нижче зазначеного рів-ня рідини в посудені. Знайдемо співідношення для розрахунку висоти рідини в ка-пілярі в випадку часткового змочування.
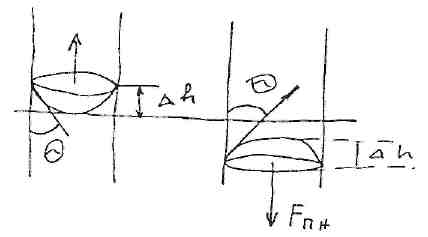
Pл = 2Ө/R не зрівноважелись з гідростатичним тиском Р= ρgh; Рл = ρgh; h=2σ*cosӨ/ ρghк
9.Рідкі розчини, масова та молярна їх концентрації. Закони Рауля та Генрі для різних розчинів.
10.Типи міжатомної взаємодії в кристалах. Кристалічна ґратка. Дефекти в кристалах.
Якщо порівнювати тв. тіла за їх фіз.. власт. та аналізувати природу сил між мол. взаємодії, то виділяють 4 основні типи між мол. зв’язків: взаємодія Ван-дер-Ваальса, іонний зв’язок, ковалентний зв’язок, металічний зв’язок.
Ван-дер-Ваальсівська взаємодія має місце у всіх тв. тілах, але визначальною вона є в кристалах інертних речовин. По своїй природі є дипольною взаємодією і виникає між ел. нейтральними атомами. Іонний зв’язок є характерним для металів 1 групи, у яких на зовн. оболонці лише 1 електрон, який х-зується дуже слабким зв’язком цього електрону із атомним залишком. У атомів елементів 7 групи на зовн. електронній оболонці до повного “заповнення” не вистачає 1 електрона, і вони легко приймають лишній електрон для формування стійкої електронної групи, перетворюючись при цьому в негативний іон. Прийняття чи віддача атомом електрона приводить до перетворення атома у відповідним чином заряджений іон, і між іонами виникає значна кулонівська взаємодія. Іонні кристали х-зуються великою Е зв’язку (високі Т плавлення), а в механічному відношенні вони х-зуються високою міцністю і твердістю. Якісною х-кою ковалентного зв’язку є усуспільнення зовнішніх електронів двома або більшим числом атомів з утв. стійких електронних груп. Найбільш чітко утв. ковалентного зв’язку проявляється у речовин 4 групи. Кристали з ковалентним типом зв’язку в більшості за нормальних умов – діелектрики, у них також значні Т плавлення, х-зуються твердістю і міцністю. В атомів металів на зовнішній електронній оболонці міститься мала к-ть електронів, якої недостатньо для утв. ковалентного зв’язку і при чому ці електрони слабо взаємодіють з атомним залишком, через що вони можуть легко покидати межі атомів. В металах не може існувати також іонний зв’язок, бо всі іони одного знаку. Утв. відбувається завдяки взаємодії вільних електронів металу (електронний газ) із (+) зарядженими атомними залишками. Оскільки до металів відносяться елементи 1-3 групи, як 1-валентні так і 3-валентні, то різною для різних металів є Е зв’язку, Т плавлення, як і механічні властивості суттєво різняться.
Під
атомним рядом розуміють напрям в
кристалічному тілі, в якому розташовується
дуже велике число атомів. Атомна площина
– площина виділена в тв. тілі в якій
розташовується дуже велике число атомів.
Під кристалічною
граткою
розуміють просторово-періодичну
структуру, яка утворилася при перетині
всеможливих атомних рядів у тв. тілі.
Для того, щоб описувати положення вузлів
кристалічної гратки виберемо відповідну
кристалографічну с-му координат. Її
вибираєм так, щоб симетрія системи
координат mах відтворювала симетрію
кристадічної речовини. В такій системі
координат положення
атома А буде задавати радіус-вектор
 .
a,b,c
– вектори
трансляції, а їх модулі – періоди гратки.
Паралелепіпед побудований на векторах
трансляції наз. елементарною коміркою.
.
a,b,c
– вектори
трансляції, а їх модулі – періоди гратки.
Паралелепіпед побудований на векторах
трансляції наз. елементарною коміркою.
Дефекти в кристалах
В монокристалічних тілах існує дальній порядок в розташуванні атомів. Проте в реальних монокристалах завжди існують такі області, в яких порушується періодичність в розташуванні атомів. Такі області наз. дефектами. В залежності від розмірів дефектних областей проводять їх класифікацію.
Точкові дефекти – розміри яких співрозмірні з розмірами атомів в 3 взаємоперпендикулярних напрямках.
Лінійні – у двох напр. співрозмірні, а в третьому >>
Плоскі – в 1співрозмірні, а в 2-х >>
Об’ємні – у всіх 3 рапрямках дефект >> за розміри атома
До точкових дефектів відносять: вакансії – місця, де згідно дальнього порядку повинен бути атом, але він відсутній; атоми заміщення – у вузлі гратки, де повинен знаходитися атом одного сорту, знаходиться атом іншого сорту; атоми втілення – атоми, які знаходяться в місцях ”не передбачених” дальнім порядком.
Вакансії відіграють одну з основних ролей при протіканні дифузійних процесів в тв.тілах, вони є термодинамічно рівноважними дефектами. Поблизу точкових дефектів має місце зміщення сусідніх атомів із рівноважних положень
До лінійних дефектів відносяться в основному крайові і гвинтові дислокації. Крайову дислокацію можна розглядати як лінію обриву атомної площини в кристалі. Значні порушення в розташуванні атомів мають місце издовж “лінії обриву”.
Поверхневі деформації утв. в основному в процесі отримання кристалічних матеріалів, і інколи при механічній дії на кристал.
До об’ємних дефектів відносяться: включення іншої фази, мікропори, мікротріщини. Мікропори і включення іншої фази утворюються в кристалах в процесі їх вирощування, а мікротріщини – при механічній дії на кристал.
11.Фазові перетворення 1-го та 2-го роду. Рівняння Клайперона-Клаузіуса. Фазова діаграма. Потрійна точка.
Зміна складу речовини яка супроводжуються різними змінами деяких власт. чи параметрів наз. фазовим перетворенням.
Розрізняють фазові переходи 1–го і 2–го роду. Фазові перетв. 1-го роду наз. зміну стану системи, яка супроводжується зміною внутрішньої Е. (плавлення, пароутворення, сублімація). Фазові перетв. 2–го роду наз. зміну стану речовини, яка супроводжується зміною Т величин зв’язаних з похідною від Е по Т (σ,χ). Фазові перетв.2–го роду відбув. тільки в тв. тілах за винятком рідкого Не, який при T=const переходить у надтекучий стан.
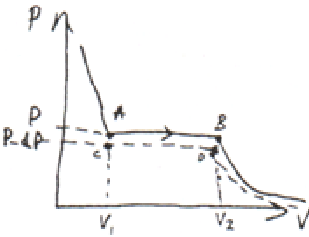
Ізотерми реального газу дозволяють отр. рівняння Клайп– Клауз.
Розгл. ізотерму Ендрюса побудовану для к-ті моль речовини і розгл. в якості початкової с–ми с-му, що відповідає т.А, тобто стану в якому вся речовина знах. в рідкому стані і над нею відсутня насичена пара. При повільному збільшені об’єму рухаючи поршнем при T = const тут буде відбув. перетв. рідини в газоподібний стан і поки вона переходитиме в цей стан, буде забирати від нагрівника теплоту Qзатр = υL, L- молекулярна теплота пароутв. В т.В від’єднаємо с–му від нарівника і проведемо незначне адіабатне розширення газу до точки С, при цьому р зменшиться на dP і стане P-dP в об’ємі V – dV, а температура T – dT і проведемо зменшення об’єму до стану D, з якого адіабатичним стисненням її можна перевести в точковий стан А.
Тут замкнутий процес ABCD представляє цикл Карно і визначити його ККД можна двояко з одного боку η = dT/T з іншого η = Aц /Qзат
Роботу за циклом знайдемо як фігуру обмежену лініями циклу
Ац = (V1–V2)dp η = (V1–V2)dp/ Qзат = (V1–V2)dp/L,
V2 = υ2 /υ, V1 = υ1 /υ молярний обєм відповідно V2 – класична пара та V1 – рідини при температурі Т. (V1–V2)dp/L = dT/T,
dP/dT = 1/T(V1–V2), рів. Клайп – Клауз визначає зміну тиску насиченої пари із зміною Т. Часто його записують в іншому вигляді dP/dT = Т*(V1–V2)/L виражає зміну Т фазового перетв. речовини із зміною тиску причому вони є універсальними і нами розгул. для різних фазових перетворень.
Кристалізація – процес переходу речовини з рідкого у тв. стан. Відбув при T=const і супроводжується виділенням певної к-ті тепла Qкр = λw, λ - густина питомої кристалізації. λ = Qкр / w, показує яка к-ть теплоти виділяється при кристалізації маси речовини.
Плавлення – це процес переходу речовини з тв. стану в рідкий. Плавлення кристалічної речовини відбув. при T=const Тпл = Ткр . Для протікання процесу плавлення до речовини потрібно підводити певну к-ть теплоти. Ця теплота витрачається на збільшення к-ті степенів вільності.dT/dP = T(Vтв –Vр), Т плавлення змін. із зміною зовнішніх парам. Ці зміни описуються рів. Клайперона – Клаузіуса. Якщо побудувати залежність Т плавлення від зовнішнього тиску то утв. характернана крива, яка / діаграму на обл. газоподібної, рідкої та тв. фази. Проаналізуємо перехід речовини з рідкого в газоподібний стан. Обидві криві на РТ діаграмі переміщуються в т.А, в якій одночасно можуть існувати 3 речовини ця т. наз. потрійною точкою.

12.Дифузія в газах. Закони Фіка. Коефіцієнт дифузії при стаціонарній дифузії.
Дифузія газів. Закони Фіка. Коефіцієнт дифузії при стаціонарній дифузії.
Процес дифузії полягає у вирівнюванні густини чи складу газу. Якщо процес дифузії розглядається в однорідному середовищі, то в ньому беруть участь лише однакові молекули, і цей процес називається самодифузією. Якщо в процесі дифузії відбувається вирівнювання концентрацій різних компонент системи, то цей процес називається (взаємною) дифузією.
В процесі дифузії створюються потоки молекул із області вищої в область нижчої концентрації в сторону максимального зменшення концентрації. Чисельно дифузійні потоки характеризуються величиною
 (1)
або
(1)
або
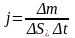 (2)
(2)
Дифузійні потоки завжди приводять до зменшення різниці концентрації, яка їх викликала. В замкнутій системі відбувається врівноваження концентрації, тобто нестаціонарна дифузія. Дифузія, при якій різниця концентрацій в системі не змінюється, називається стаціонарною, для якої необхідна дія сторонніх факторів.
Експериментально встановлено, що дифузійний потік пропорційний градієнту концентрації. Це – перший закон Фіка:
 (3),
х – напрямок максимальної зміни
концентрації
(3),
х – напрямок максимальної зміни
концентрації
(3)
описує процес стаціонарної дифузії,
коли
 .
Згідно (3) можна знайти миттєве значення
дифузійного потоку протягом малого
інтервалу часу
.
Згідно (3) можна знайти миттєве значення
дифузійного потоку протягом малого
інтервалу часу
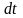 ,
за який градієнт концентрації можна
вважати незмінним. При нестаціонарній
дифузії градієнт концентрації зменшується
з часом.
,
за який градієнт концентрації можна
вважати незмінним. При нестаціонарній
дифузії градієнт концентрації зменшується
з часом.
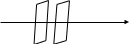
n1 n2 х
n1>n2
x x+dx
При нестаціонарній дифузії:
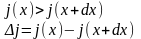 (4)
(4)
 йде на збільшення концентрації молекул
в області між перерізами. Вважаємо dx
малим
і незмінним:
йде на збільшення концентрації молекул
в області між перерізами. Вважаємо dx
малим
і незмінним:
 .
Тоді, враховуючи означення дифузійного
потоку, запишемо
.
Тоді, враховуючи означення дифузійного
потоку, запишемо
 (5)
(5)
Представимо j(l+x) через зміну градієнта концентрації з відстанню
 (6)
(6)
 (7)
(7)
Прирівнявши з (5) і (7), отримаємо:

 (8)
– другий закон Фіка, який пов’язує
швидкість зміни концентрації з часом
із зміною градієнта концентрації з
відстанню.
(8)
– другий закон Фіка, який пов’язує
швидкість зміни концентрації з часом
із зміною градієнта концентрації з
відстанню.
Розглянемо посудину з газом, в об’ємі якої концентрація не однакова, а змінюється так, що в будь-якій площині, перпендикулярній до певного напрямку(осі ОХ), концентрація має однакове значення. Зміна концентрації можлива лише вздовж вибраного напрямку.
n=f(x) (9)

N1
n1 N2 n2 x
n1>n2
Виберемо
площадку площею S,
перпендикулярну до осі ОХ. За однаковий
малий проміжок часу dt
число молекул, які пройдуть крізь неї,
не буде рівним у взаємно протилежних
напрямках (N1>N2),
оскільки концентрація молекул по різні
боки різна. Виділимо перерізи, що
знаходяться від розглянутої площадки
на відстані по обидві сторони. Позначимо концентрації
в цих перерізах
по обидві сторони. Позначимо концентрації
в цих перерізах
 та
та
 .
.
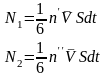 (10)
(10)
 -
об’єм, з якого молекули переходять
через площадку.
-
об’єм, з якого молекули переходять
через площадку.
Визначимо величину дифузійного потоку.
 (11)
(11)
 (12)
(12)
 (13)
(13)
 (14)
(14)
Порівнюючи (14) з першим законом Фіка (3), отримаємо:
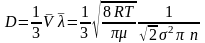 (15)
– коефіцієнт стаціонарної дифузії
(15)
– коефіцієнт стаціонарної дифузії
13.Теплопровідність, закон Фур’є для теплопровідності. Механізми протікання теплопровідності в різних речовинах.
