
- •Аннотация
- •Введение
- •1 Аналитический обзор литературы
- •1.1 Особенности кристаллической и магнитной структуры, физические свойства иттрий-железистого граната (y3Fe5o12)
- •1.2 Дефекты нестехиометрии в структуре ижг
- •1.3 Процессы спекания феррогранатов в регулируемой газовой среде
- •1.3.1 Процесс спекания феррогранатов состава y3GaхFe5-хO12
- •1.3.2 Влияние газовой среды на процесс спекания феррогранатов состава y3Fe5о12
- •2 Методика экспериментальных исследований
- •2.1 Технология и основы производства ферритов
- •2.2 Прессование ферритовых изделий
- •2.2.1 Изготовление изделий методом прессования
- •2.2.2 Ферритизация, спекание и другие виды термической обработки ферритовых материалов и изделий.
- •2.3 Методика определения тангенса угла диэлектрических потерь и диэлектрической проницаемости при частотах от 50 до 108 Гц
- •2.3.1 Образцы для испытаний
- •2.3.2 Испытательная аппаратура
- •2.3.3 Проведение эксперимента
- •2.3.4 Определение диэлектрической проницаемости ԑ, тангенса угла диэлектрических потерь tgδԐ и проводимости γ методом волноводных линий
- •2.3.5 Определение ԑ', ԑ" и γ методом «тонкого стержня»
- •2.3.6 Магнитная восприимчивость (метод магнитных весов)
- •3 Результаты экспериментальных исследований
- •3.1 Результаты влияния отжига на основные электромагнитные характеристики
- •3.2 Влияние состава и температуры выращивания на образование пор в монокристалле
- •3.3 Расчет концентрации пор в структуре ижг
- •4 Техника безопасности
- •4.1 Основы электробезопасности при производстве ферритовых элементов
- •4.1.1 Основы техники безопасности при производстве ферритовых изделий
- •4.1.2 Общие положения
- •4.1.3 Обработка сырьевых материалов, помол и приготовление шихты
- •4.2 Общие требования безопасности
- •4.3 Специальные требования безопасности
- •4.3.1 Транспортировка баллонов
- •4.3.2 Хранение баллонов
- •4.3.3 Эксплуатация баллонов
- •4.3.4 Ответственность за невыполнение инструкции
- •4.4 Инструкция по оказанию первой доврачебной помощи
- •4.4.1 Общие положения
- •4.4.2 Помощь при поражении электрическим током
- •4.4.2.1 Искусственная вентиляция легких
- •4.4.2.2 Наружный массаж сердца
- •4.4.3 Остановка кровотечения
- •4.4.4 Оказание помощи при ранениях
- •4.4.5 Оказание помощи при ушибах
- •4.4.6 Помощь при переломах
- •4.4.7 Помощь при ожогах
- •4.4.8 Помощь при отравлении газами
- •4.4.9 Помощь при микротравмах
- •4.4.10 Первая помощь при отморожении
- •4.4.11 Первая помощь при попадании инородных тел органы и ткани
- •4.4.12 Первая помощь при обмороке, тепловом и солнечном ударах
- •4.4.13 Помощь при укусе животных
- •4.4.14 Взрывные травмы
- •Список используемых источников
Введение
С развитием микрополосковой СВЧ-техники и миниатюризацией интегральных ферритовых устройств, повышаются требования к магнитным параметрам ферритовых материалов.
В настоящее время для изготовления устройств микрополосковой СВЧ-техники в качестве подложек широко используются поликристаллические феррогранаты, спеченные в атмосфере кислорода при температурах 1450оС – 1500оС. Плотность полученного материала при этом составляет 98% от монолитного материала.
Отжиг в кислородной атмосфере феррита со структурой ИЖГ в большей степени влияет на такие электромагнитные параметры, как тангенс диэлектрических и магнитных потерь.
В связи с этим, целью данной работы являлось снижение электромагнитных и диэлектрических потерь в иттрий-железистом гранате путем проведения высокотемпературного отжига в атмосфере кислорода.
Подобные результаты обеспечивают актуальность данной работы.
1 Аналитический обзор литературы
1.1 Особенности кристаллической и магнитной структуры, физические свойства иттрий-железистого граната (y3Fe5o12)
Кристаллические материалы со структурой граната относятся к группе соединений, изоморфных природным минералам-ортосиликата Ca3Al2(SiO4)3. Элементарная решетка является объемоцентрированной кубической (ОЦК) и содержит 8 формульных единиц (160 ионов). Пространственная группа Оh10 = Ia3d, точечная m3m. Общую химическую формулу этих минералов можно представить в виде R3Me5O12, где R - ион Y или редкоземельный ион, Me - ион Ga (галлаты), Al (алюминаты), Fe (феррогранаты) или другие преимущественные трехвалентные ионы. Фрагмент кристаллической структуры в соответствии с рисунком 1.
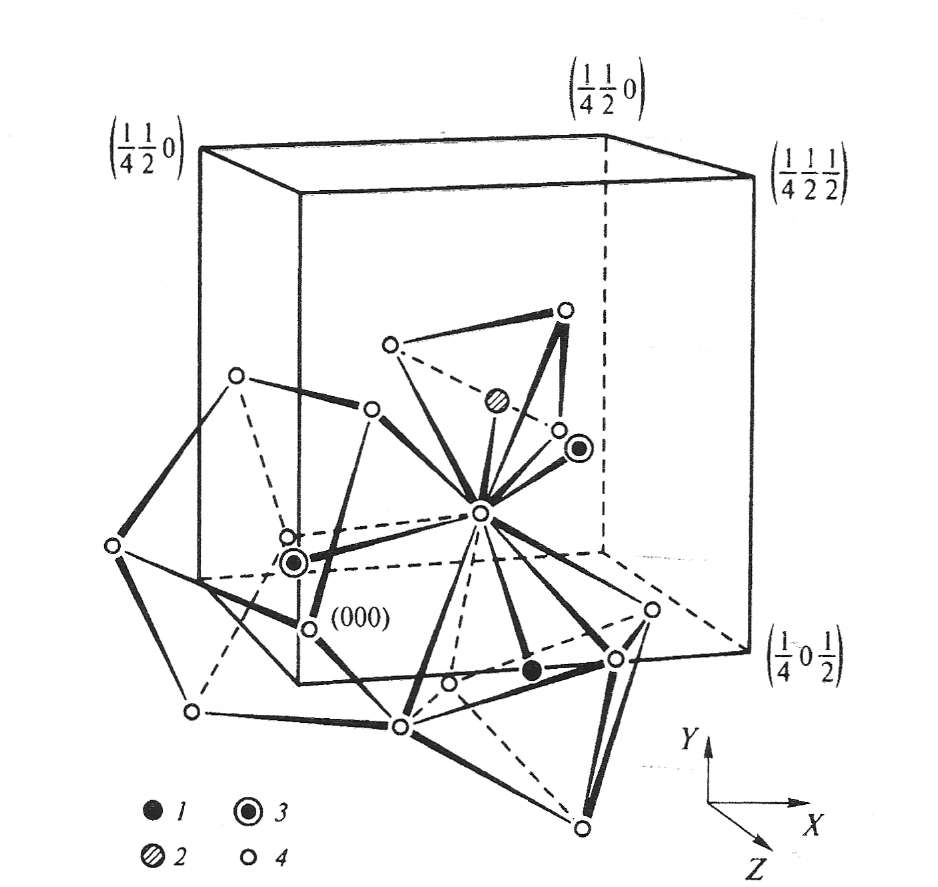
1 – катион в 16а-положении (0, 0, 1/2); 2 – катион в 24d-положении (0, 1/4, 3/8);
3 – катионы в 24с-положениях (1/4, 1/8, ½ и 0, ¼ , 5/8); 4 – ионы О2- ;
цифры обозначают координаты ионов, выраженные в долях параметра элементарной ячейки
Рисунок 1 - Фрагмент кристаллической решетки структуры граната
В такой структуре ионы кислорода образуют ОЦК-решетку по типу плотнейшей упаковки шаров, представляющую чередование кислородных слоев двух типов. 64 металлических иона занимают междоузлия кислородной подрешетки. Существуют три типа кристаллографически неэквивалентных катионных позиций: 24 додекаидрические (с-положение) с координационным числом (к.ч.) = 8, 16 октоэдрических (а-положения) с к.ч. = 6 и 24 тетраэдрических (d-положения) с к.ч. = 4 [1,2]. 96 анионов (ионов кислорода) занимают общие, так называемые h-положения с отличными от нуля кислородными параметрами x, y и z, значение которых определяется катионным составом граната [3,4].
Все кислородные многогранники (полиэдры) в структуре граната искажены (хотя пространственная группа допускает существование и правильных многогранников) [3,5]; локальная симметрия во всех a-, c- и d-положениях не является строго кубической. Симметрия с-положений с различной ориентацией локальных осей симмтрии относительно кубических осей. Ортоэдрические места характеризуются тригональной симметрией, причем имеется два типа искаженных октаэдров, повернутых относительно осей [111] на угол ±28,6о.
Тетраэдры развернуты относительно осей [100] на углы ±15,4о, то есть образуются два типа неэквивалентных мест. Степень деформации кислородных многогранников определяется положением ионов кислорода, каждый из которых принадлежит двум додекаэдрам, октаэдру и тетраэдру [1-3,5]. Вдоль осей [111] ближайшие октаэдры связаны кольцом из двух додекаэдров, лежащих на плоскостях {111} и повернуты на углы, близкие к 30о[4]. Для структуры гранатов в отличие от других сложных оксидных кристаллов характерны большая изоморфная емкость (способность замещения различными катионами в положении с, а и d) и занятость всех катионных позиций. Это связано с тенденцией к сохранению общей кубической симметрии ячейки при свободном упорядочении кислородных полиэдров. Данный факт обуславливает высокую стабильность структуры, а так же невозможность больших отклонений от стехиометрии и образование дефектных структур с вакансионным упорядочением, что характерно для шпинелей [6] и перовскитоподобных кристаллов[7].
Катионное распределение в структуре граната по с-, а- и d-позициям принято обозначать соответственно фигурными, квадратными и круглыми скобками {Re33+} [Me23+] (Me33+)O122-.
Остановимся более подробно на особенностях кристаллической и магнитной структуры железо-иттририевого граната (ЖИГ) {Y33+} [Fe23+] (Fe33+)O122-, используемого часто для создания сложнозамещенных редкоземельных ферриотов-гранатов с широким разнообразием свойств. Между всеми тремя подрешетками ЖИГ согласно модели Нееля [8] и Потене [9] действует отрицательное обменное взаимодействие. Наиболее сильным является антиферромагнитное обменное взаимодействие между ионами Fe3+, находящимися в а- и d-подрешетках. В результате этого взаимодействия гранат Y3Fe5O12 при температурах ниже Тс~553 К становится коллинеарным ферромагнетиком с направлением магнитного момента типа «легкая ось» вдоль [111] или типа «легкая плоскость». Угол связи в цепочке Fe3+(a) – O2- - Fe3+(d) составляет 127о, а цепочки Y3+(c) – O2 - Fe3+(d) и Y3+(c) – O2 - Fe3+(a) составляют, соответственно 122о и 100о, поэтому и энергия взаимодействия здесь меньше.
Совсем мало внутриподрешеточное взаимодействие в цепочках Fe3+(a) – O2- - Fe3+(а) и Fe3+(d) – O2- - Fe3+(d) из-за неблагоприятного расположения ионов внутри подрешеток. Исследование ферритов-гранатов методом мессбауэровской спектроскопии [10] позволили заключить, что внутри а- и d-подрешеток косвенные взаимодействия между ионами Fe3+ осуществляется через два аниона кислорода в цепочке Fe3+(a) – O2- - О2- - Fe3+(а) и Fe3+(d) – O2- - О2- - Fe3+(d), а в случае замещенных ферритов-гранатов через немагнитный катион (например, Ga3+ или Ge4+) Fe3+(d) – O2- - Ga3+ - Fe3+(d) [11].
Намагниченность насыщения ферритов-гранатов R3Fe5O12 определяется намагниченностью додекаэдрической подрешетки и разностью намагниченностей тетра- и октаэдрической подрешеток железа, магнитные моменты которых направлены антипараллельно. Ориентация магнитного момента в редкоземельной подрешетке определяется типом редкоземельного элемента, например, для Pr3+ и Nd3+он параллелен магнитному моменту d-подрешетки, а для Gd3+ и Yb3+- магнитному моменту а-подрешетки. Намагниченность ЖИГ определяется только разностью намагниченностей тетра- и окта-подрешеток (ион Y3+- немагнитен) и равна 140,6кА/м (1760Гс).
Критерием стабильности структур R3Fe5O12 является соотношение ионных радиусов rR3+/rFe3+≤1,7 [12]. Это условие выполняется для редкоземельных элементов, расположенных в периодической системе Д.И. Менделеева правее Nd, а более крупные – La, Ce, Pr могут лишь частично замещать додекаэдрические позиции. Для заполнения а- и d- подрешеток кроме соответствующей величины ионного радиуса, катион должен обладать сферической симметрией электронных оболочек в основном состоянии. Из 3d-элементов только Fe3+ может полностью занимать обе подрешетки, поскольку в основном состоянии имеет равный нулю орбитальный момент в кристаллическом поле и окта- и тетраэдрической симметрии [13]. Каждый ион Fe3+ находится в 3d5 электронной конфигурации и имеет момент 5μБ, так что разница в моментах подрешетки железа составляет 5μБ [14].
Для регулирования намагниченности ионы железа замещают немагнитными ионами Ga3+, Al3+, Sc3+ и др. [15, 14]. Любой немагнитный ион , замещающий ион железа в тетраэдрической подрешетке, уменьшает полную намагниченность материала. Замещение ионов в октаподрешетке приводит к уменьшению Ms. Согласно трактовке авторов [15] при замещении ионов Fe3+ на Ga3+ уже примерно 90% Ga3+ занимают тетраэдрические позиции и 10% - октаэдрические. подрешетке, уменьшает полную намагниченность материала.
Таблица 1 - Основные характеристики пленок ЖИГ
Основные характеристики |
Обозначение |
Величина |
Источник |
Намагниченность насыщения, кА/м |
Ms |
140,60 |
[20] |
Параметр обменного взаимодействия, пДж/м |
A |
3,70 |
[10] |
Константы магнитострипции |
Λ111 Λ100 |
-(2,40∙10-6– 2,90∙10-6) - 1,40∙ 10-6 |
[11,12] [11,12] |
Константа магнитной анизотропии: кубической, одноосной, кДж/м3 |
Ккуб. Кодн. |
-5,70 0,60 |
[15] [10] |
Постоянная кристаллической решетки, нм |
af |
1,24 |
[10,13,14] |
Температура Нееля, К |
TN |
553,00 |
[10] |
Модуль Юнга, ГПа |
E |
187,00 |
[10] |
Коэффициент Пуассона |
Ν |
0,29 |
[10,11] |
Плотность, кг/м3 |
Ρ |
5,17∙103 |
[14] |
Удельное фарадеевское вращение , град/см (Т=300К; λ=1,152мкм) |
ѲF |
245,00 |
[15] |
Коэффициент оптического поглощения, см-1 (Т=300К; λ + 1,152мкм) |
Α |
~10,00 |
[15] |
При замещении Fe3+ на Ge4+ уже примерно 98% ионов Ge4+ занимают тетрапозиции, а компенсирующие заряд иона Са2+ - додекаэдрические узлы [6]. Замещение магнитных ионов на немагнитные приводит к ослаблению основного а – d-взаимодействия и уменьшению температуры Нееля ТN [12-14,15]. При диамагнитном замещении ионов Fe3+ в d-подрешетке ТN уменьшается значительно меньше, чем в замещении а-подрешетке. Это объясняется тем, что согласно статистической моделе Джиллео[12] при тетраэдрическом замещении образуется в пять раз меньше ионов Fe3+ со слабыми обменными связями, чем в случае октаэдрического замещения. Так, для получения той же намагниченности при германиевом замещении ТN, как правило, на 70-100К выше, чем при Ga3+ -замещении [11].
