
- •1)Система отсчета. Материальная точка. Радиус-вектор и вектор перемещения, их связь с координатами точки. Траектория.
- •2)Средняя и мгновенная скорости. Ускорения. Закон равноускоренного движения.
- •3)Движения тела по окружности. Угловая скорость, нормальное и тангенциальное ускорение. Движение по криволейной траектории.
- •4)Инерциальные системы отсчета, первый закон Ньютона.
- •5)Масса и импульс материальной точки. Сила. Второй закон Ньютона.
- •6)Третий закон Ньютона. Преобразования Галилея.
- •7)Замкнутая система материальных точек. Закон сохранения импульса.
- •8)Центр масс, система центра масс.
- •9)Момент импульса, закон сохранения момента импульса.
- •10)Работа и мощность силы. Средняя и мгновенная мощность.
- •11)Консервативные силы, работа консервативных сил.
- •12)Потенциальная энергия. Закон сохранения механической энергии.
- •13)Упругие и квазиупругие силы. Закон Гука. Гармонические колебания: частота, период, амплитуда и фаза колебаний.
- •14)Дифференциальное уравнение гармонических колебаний. Гармонические колебания пружинного и математического маятников.
- •15)Затухающие колебания. Коэффициент затухания и логарифмический декремент затухания.
- •16)Энергия гармонических и затухающих колебаний.
- •17)Вынужденные колебания. Резонанс.
- •18)Основные положения молекулярно-кинетической теории. Масса и размеры молекул.
- •19)Термодинамическая система и параметры её состояния.
- •20)Связь кинетической энергии молекул газа с температурой и давлением.
- •21)Равнораспределение энергии по степеням свободы.
- •22)Число степеней свободы и средняя энергия многоатомной молекулы.
- •23)Внутреняя энергия термодинамической системы.Теплоёмкость.
- •24)Работа, совершаемая газом при изменении объема.
- •25)Распределение молекул газа по скоростям. Функция распределения и её нормировка. Функция распределения Максвелла.
- •26)Наиболее вероятная, средняя и средне-квадратичная скорости молекул.
- •27)Опыт Штерна
- •28)Опыт Ламмерта
- •29)Идеальный газ в поле сил тяжести, барометрическая формула. Распределения Больцмана.
- •30)Основы термодинамики.
- •31)Тепловые двигатели и их кпд.
- •32)Адиабатический процесс. Работа газа при различных процессах.
- •33)Круговой процесс. Цикл Карно. Кпд цикла Карно.
- •34)Уравнения состояния идеальных газов. Уравнение Ван-дер-Ваальса.
- •35)Приведенная теплота. Энтропия.
- •36)Изменения энтропии в изопроцессах.
- •37)Свободная и связанная энергии.
- •38)Статистический смысл энтропии.
33)Круговой процесс. Цикл Карно. Кпд цикла Карно.
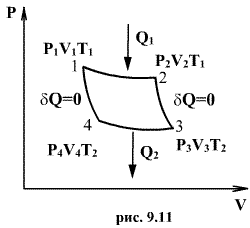
Анализируя работу тепловых двигателей, французский инженер С. Карно в 1824г. пришел к выводу, что наивыгоднейшим круговым процессом является обратимый круговой процесс, состоящий из двух изотермических и двух адиабатических процессов, т.к. он характеризуется наибольшим коэффициентом полезного действия. Такой цикл получил название цикла Карно. В прямом цикле Карно рабочее тело изотермически, а затем адиабатически расширяется, после чего снова изотермически (при более низкой температуре) и потом адиабатически сжимается. Т.е. цикл Карно ограничен двумя изотермами и двумя адиабатами.
При
изотермическом расширении от нагревателя
отбирается тепло ![]() (на
участке 1-2 рис. 9.11). Вследствие этого
температура газа поддерживается
неизменной. Соответственно, параметры
точки 2 будут равны
(на
участке 1-2 рис. 9.11). Вследствие этого
температура газа поддерживается
неизменной. Соответственно, параметры
точки 2 будут равны ![]() .
На участке 2-3 происходит адиабатное
расширение. Внутренняя энергия газа
уменьшается и его температура падает
до Т2. Параметры точки 3 -
.
На участке 2-3 происходит адиабатное
расширение. Внутренняя энергия газа
уменьшается и его температура падает
до Т2. Параметры точки 3 - ![]() .
На участке 3-4 газ изотермически сжимается.
Параметры точки 4 -
.
На участке 3-4 газ изотермически сжимается.
Параметры точки 4 - ![]() .
Выделяющееся при этом тепло
.
Выделяющееся при этом тепло ![]() отбирается
холодильником. Участок 4-1 -адиабатическое
сжатие до исходного состояния,
соответствующего точке 1. Таким образом,
завершен цикл “1-2-3-4-1 и в итоге нагреватель
отдал газу теплоту
,
а холодильник отобрал
Разность
отбирается
холодильником. Участок 4-1 -адиабатическое
сжатие до исходного состояния,
соответствующего точке 1. Таким образом,
завершен цикл “1-2-3-4-1 и в итоге нагреватель
отдал газу теплоту
,
а холодильник отобрал
Разность ![]() определяет
полезную работу газа за один цикл, так
как согласно I началу термодинамики
определяет
полезную работу газа за один цикл, так
как согласно I началу термодинамики ![]() ,
но для кругового процесса
,
но для кругового процесса ![]() и,
следовательно
и,
следовательно ![]() .
.
Отношение
полезной работы к затраченной энергии
нагревателя определяет коэффициент
полезного действия (к.п.д.) тепловой
машины:
![]()
34)Уравнения состояния идеальных газов. Уравнение Ван-дер-Ваальса.
В МКТ и термодинамике идеального газа макроскопическими параметрами являются: p, V, T, m.
Мы
знаем, что ![]() .
Следовательно,
.
Следовательно, ![]() .
Учитывая, что
.
Учитывая, что ![]() ,
получим:
,
получим: ![]() .
.
Произведение
постоянных величин есть величина
постоянная, следовательно: ![]()
- универсальная газовая постоянная (универсальная, т.к. для всех газов одинаковая).
Таким
образом, имеем: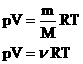 -
уравнение состояния (уравнение Менделеева
– Клапейрона).
-
уравнение состояния (уравнение Менделеева
– Клапейрона).
Если n=1
моль, то, обозначив объем одного моля Vм,
получим: ![]() .
.
Для нормальных условий получим:
![]()
Запись
уравнения через плотность: ![]() -
плотность зависит от температуры и
давления!
-
плотность зависит от температуры и
давления!
Часто
необходимо исследовать ситуацию, когда
меняется состояние газа при его неизменном
количестве (m=const) и в отсутствие химических
реакций (M=const). Это означает, что количество
вещества n=const. Тогда: ![]()
Для
постоянной массы идеального газа
отношение произведения давления на
объем к абсолютной температуре
в данном состоянии есть величина
постоянная: ![]() .
.
Ван-дер-Ваальсом в уравнение Клапейрона — Менделеева введены две поправки.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не Vm, а Vm — b, где b — объем, занимаемый самими молекулами.
Объем b равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра d молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса d, т. е. объем, равный восьми объемам молекулы или учетверенному объему молекулы в расчете на одну молекулу.
2.
Учет притяжения молекул. Действие сил
притяжения газа приводит к появлению
дополнительного давления на газ,
называемого внутренним давлением. По
вычислениям Ван-дер-Ваальса, внутреннее
давление обратно пропорционально
квадрату молярного объема, т. е.
![]()
где а — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, Vm — молярный объем.
Вводя
эти поправки, получим уравнение
Ван-дер-Ваальса для моля газа (уравнение
состояния реальных газов):
![]()
Для произвольного количества вещества v газа (v=m/M) с учетом того, что V=vVm, уравнение Ван-дер-Ваальса примет вид

