
- •3. Реакции аллильного замещения
- •1. Реакции электрофильного присоединения (ае).
- •2) Фенолы
- •3. Замещение гидроксильной группы.
- •2)Карбоновые кислоты
- •2) Серосодержащие соединения
- •Тиолы, тиоэфиры
- •Сульфоксиды, сульфоны
- •Сульфоновые кислоты (сульфокислоты)
- •2)Ароматические соли диазония
- •2)Диазолы
- •2)Пиридин и его гомологи
- •Природные и лекарственные вещества – производные пиридина
- •Хинолин
- •2) Аминокислоты
- •2)Углеводы (I)
- •Динуклеотиды
- •Аденозинтрифосфат (атф)
- •2)Изопреноиды I
- •Монотерпены а) ациклические монотерпены
- •Б) моноциклические монотерпены
- •Тетратерпены Каротиноиды
2) Фенолы
Фенолы – ароматические спирты.
Они широко представлены в растительном мире: пигменты, дубильные вещества, лигнин. Используются в технике, медицине, фармации: полимеры, красители, консерванты, антисептики.
Физические свойства
Одноатомные фенолы – низкоплавкие твердые вещества с характерным запахом ("карболка", крезолы). Многоатомные – менее летучи, без запаха. Фенол мало растворим в воде, хорошо растворим в органических растворителях. Многоатомные хорошо растворимы в воде.
Химические свойства
1. Кислотность.
Фенолы значительно более сильные кислоты, чем спирты (см. тему "Кислотность и основность")
Фенол – более сильная кислота, чем вода, но менее сильная, чем угольная кислота:

2. Фенолы – нуклеофилы.
Фенолы – более слабые нуклеофилы, чем спирты. Реакцию проводят в присутствии щелочи: фенолы при этом образуют более сильные нуклеофилы – феноляты.

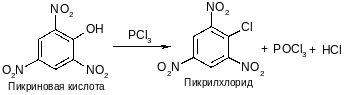
3. Замещение гидроксильной группы.
Связь С-О в фенолах более прочная, чем в спиртах (сопряжение), поэтому замена ОН на галоген с незамещенным фенолом не идет. Но введение электроноакцепторных заместителей в ядро облегчает реакцию:

4. Электрофильное замещение в ароматическом ядре.
Реакция облегчена электронодонорным действием ОН-группы (заместитель I рода)
а) галогенирование

б) сульфирование

в) нитрование

г) оксиметилирование

д) карбоксилирование (реакция Кольбе-Шмитта)

5. Окисление.


№23
1. Реакции нуклеофильного присоединения к группе С=О на примере взаимодействия карбонильных соединений с аминами.
2. Карбоновые кислоты
3. Дополните схему следующих реакций:

Реакции нуклеофильного присоединения к карбонильной группе (AN).
Механизм реакции:

Большинство таких реакций обратимы.
Фактор, определяющий скорость реакции – (+)-заряд на карбонильном атоме углерода.
Заместители R: ЭА увеличивают скорость реакции, ЭД – уменьшают.
Альдегиды более реакционноспособны, чем кетоны (алкил (R) - ЭД).
Ароматические альдегиды менее реакционноспособны, чем алифатические
(+М-эффект арильного заместителя снижает (+)-заряд на карбонильном атоме углерода).
Пространственные факторы:

г) реакции с N-содержащими нуклеофилами
Механизм "присоединение – отщепление":

амины:
2)Карбоновые кислоты
Это соединения содержащие карбонильную группу
R -C=O
OH
По числу СООН:монокарбоновые, дикарбоновые, трикарбоновые
По строению радикала: алифатические (насыщ, ненасыщ), ароматические
Систематическая номенклатура:R-овая кислота
Заместительная номенклатура: R- карбоновая кислота
Для первых членов гомологических рядов моно и декарб кислот рекомендуются тривиальные названия.
Для ароматических карб кислот родоначальная структура- бензойная кислота.
Химические свойства
Кислотность
R -COOH+ NaOH R-COO-Na+ + H2O
Кислотность карбоновых кислот выше, чем у спиртов и фенолов.
O O- O0,5-
R -C R -C или R-C
O- O O0,5-
Реакции нуклеофильного замещения
O O ацил (остаток карб
R -C + H-Nu R-C кисл)
OH -H2O Nu
Реакция ацилирования
Реакция декарбоксилирования
а)образование соед других заместителей
O 2N- CH2-COOH -CO2 O2N-CH3 все реакции идут
Нитроуксусная кисл при небольшом
N ≡C-CH2-COOH -CO2 N≡C-CH3 нагреваниии
Цианоуксусная
CH3-С- CH2-COOH -CO2 CH3-С- CH3
О ацетоуксусная О
Галогенирование
Карбоновые кислоты галогенируются легче, чем алканы, но труднее, чем карбонильные соединения
R -CH2-COOH +Cl2 PCl3 R-CH-COOH + HCl
Cl
Метод Гелля-Фольгарда- Зелинского
Взаимодействие с КОН
Н ООС-СООН КОН НООС-СОО-К+ КОН К+ООС-СООК+
кислый оксалат калия нейтральный оксалат калия
НООС-СООС2Н5 Н5 С2ООС-СОО С2Н5
Моноэтилоксалат диэтилоксалат
3)декарбоксилирование
Первые члены гомол ряда – щавелевая и малоновая кислоты- легко декарбоксилируются при незначительном нагревании.
Н ООС-СООН t* CO2 + CO+ H2O
Н ООС-CH2- СООН t* CH3-COOH+CO2
Электроноацепторное действие втрой СООН группы облегчает реакцию
4)образование циклических ангидридов
О O
Н 2С-С-ОН H2C-C
t* O янтарный ангидрид
Н 2С-С=О -H2O H2C-C
ОН O
Н2С-СООН Н2С-С=O
Н 2С t* Н2С O глутаровый
Н2С-СООН -H2O Н2С-С=O
 СООН
t*
С=О
СООН
t*
С=О
-H2O О фталевый
СООН С=О
№24
1. Реакции электрофильного замещения (SE) на примере галогенирования ароматических углеводородов. Механизм реакции. Правила ориентации в ароматическом ядре.
2. Амины:
3.
1) 1. Реакции электрофильного замещения (SЕ)
Механизм реакций SR:

1. Галогенирование
 2Амины
2Амины

Химические свойства
1. Основность.
Амины – наиболее сильные органические основания, они образуют устойчивые не гидролизующиеся соли:

Основность ароматических аминов гораздо ниже (на 2-3 порядка), но и их соли достаточно устойчивы.
2. Нуклеофильные свойства.
Нуклеофильность и основность – свойства во многом аналогичные: и та, и другая обусловлены наличием у N-атома неподеленной пары электронов.
а) реакции с алкилгалогенидами
 б)
реакции с карбонильными соединениями
б)
реакции с карбонильными соединениями
 в) реакции с
карбоновыми кислотами и их функциональными
производными – ацилирование
в) реакции с
карбоновыми кислотами и их функциональными
производными – ацилирование
O O ацил (остаток карб
R -C + H-Nu R-C кисл)
OH -H2O Nu
Реакции ацилирования
г) реакции с эпоксидами:
 3.
Реакции с азотистой кислотой.
3.
Реакции с азотистой кислотой.
а) первичные амины:
 б)
вторичные амины:
б)
вторичные амины:

в) третичные амины:
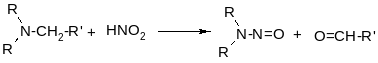
4.Электрофильное замещение в ароматических аминах.
аминогруппу предварительно защищают ацилированием: электронодонорный эффект аминогруппы при этом снижается, что предотвращает побочные реакции:

После проведения реакции ацильная защита снимается:

№25
1. Реакции электрофильного замещения (SE) на примере алкилирования ароматических углеводородов (реакция Фриделя-Крафтса).
2. Ангидриды и галогенангидриды карбоновых кислот:

1)
Реакции Фриделя-Крафтса
4. Алкилирование


РЕАКЦИИ АЦИЛИРОВАНИЯ

Легкость ухода Х уменьшается с уменьшением устойчивости аниона Х- в ряду:
Cl- > R-COO- > HO- > RO- > NH2-
Более трудно уходящая группа замещает более легко уходящую.
Галогенангидриды
2. Реакции ацилирования.
Галогенангидриды – самые активные ацилирующие агенты:
 Ангидриды-
продукты отщепления воды от двух молекул
карбоновой кислоты
Ангидриды-
продукты отщепления воды от двух молекул
карбоновой кислоты
2. Реакции ацилирования.

№26
1. Реакции элиминирования (E) на примере дегидратации спиртов.
2. Серосодержащие органические соединения:
3.

1) Реакции элиминирования с участием β-СН-кислотного центра (дегидратация)
При действии минеральных кислот или кислот Льюиса спирты отщепляют воду, превращаясь в алкены:
 Легкость
дегидратации:
Легкость
дегидратации:
первичные спирты < вторичные спирты < третичные спирты
В сложных спиртах реакция идет по правилу Зайцева.
