
- •3. Реакции аллильного замещения
- •1. Реакции электрофильного присоединения (ае).
- •2) Фенолы
- •3. Замещение гидроксильной группы.
- •2)Карбоновые кислоты
- •2) Серосодержащие соединения
- •Тиолы, тиоэфиры
- •Сульфоксиды, сульфоны
- •Сульфоновые кислоты (сульфокислоты)
- •2)Ароматические соли диазония
- •2)Диазолы
- •2)Пиридин и его гомологи
- •Природные и лекарственные вещества – производные пиридина
- •Хинолин
- •2) Аминокислоты
- •2)Углеводы (I)
- •Динуклеотиды
- •Аденозинтрифосфат (атф)
- •2)Изопреноиды I
- •Монотерпены а) ациклические монотерпены
- •Б) моноциклические монотерпены
- •Тетратерпены Каротиноиды
№19
1. Ре рад зам (SR) на галог алк. Тип акт частиц. Механизм реа и её закономерности.
2. Алкены : строение, физ и хим сво, практическое значение.3.
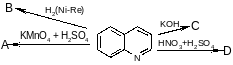
Радикал – электронейтральная частица, атакует неполярные и малополярные связи.
Активные частицы – это частицы, обладающие высокой химической активностью, они инициируют реакцию. (Гомолит. Разрыв св)
Активные частицы могут образоваться в результате разрыва химической связи. Малополярные связи разрываются гомолитически, и образуются два радикала; полярные связи разрываются гетеролитически, и образуются нуклеофил и электрофил.
галогенирование:

механизм реакции – цепной радикальный:
Скорость реакции у первичного, вторичного и третичного углеродов различна: она увеличивается в ряду: С(1) < С(2) < С(3) (см. предыдущую схему).
Причем в этом отношении хлорирование мало избирательно, бромирование гораздо более избирательно из-за меньшей активности радикала Br.
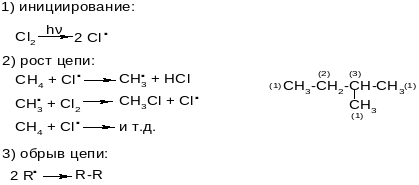 2)алкеныУглеводороды,
содержащие двойную связь общей формулы
– CnH2n.
Гомологический ряд алкенов.
2)алкеныУглеводороды,
содержащие двойную связь общей формулы
– CnH2n.
Гомологический ряд алкенов.
Физические свойства
. В гом ряду Т кип возрастает. Низшие гомологи С2-С4-газы,С5-С17-жидк, высшие гомологи ТВ. Алкены с разветвленной углеродной цепью имеют более низкие Ткип, чем изомеры с норм цепью. Хорошо растворимы в бензоле, тетрахлорметане, диэтиловом эфире, практически не растворимы в воде.
Изомерия алкенов
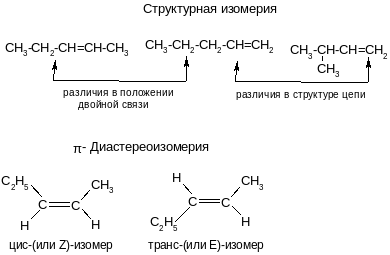
Химические свойства алкенов
Наиболее типичны для алкенов реакции присоединения (А) по схеме:
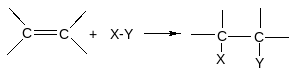
π-Связь легко поляризуется. Её атакуют электрофилы и радикалы (нуклеофилы - редко).
1Реакции электрофильного присоединения (АЕ).
а) гидратация и присоединение галл.
С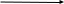 Н2=СН2
Н2О,Н+
СН3-СН2-ОН
Н2=СН2
Н2О,Н+
СН3-СН2-ОН
 СН2=СН2
hal(Br)
Br-CH2-CH2-Br
СН2=СН2
hal(Br)
Br-CH2-CH2-Br
 СН2=СН2
Hhal
CH3CH2Hal
СН2=СН2
Hhal
CH3CH2Hal
Реакция проходит в сильно кислой среде, ион Н+
является атакующим электрофилом.
Механизм реакции:
Правило Марковникова:
При присоединении воды или галогеноводорода к алкенам водород присоединяется к наиболее гидрогенизированному атому углерода.
Правило Марковникова соблюдается для ув и для тех производных, которые имеют у двойной связи электронодонорный заместитель. Напр:
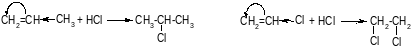
Для соединений, имеющих у двойной связи электроноакцепторный заместитель, реакция идет против правила Марковникова.
Например:
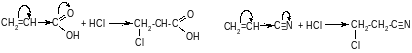
б) присоединение серной кислоты
 в)
присоединение галогенов.
в)
присоединение галогенов.
Реакция с фтором из-за слишком большой его активности проходит с разрывом С-С-связей и разрушением цепи. Лучше всего присоединяются хлор и бром. Реакция с иодом идет медленно и равновесно.
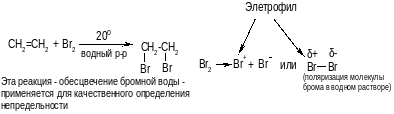
г) присоединение хлорноватистой кислоты.
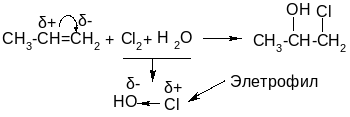
Сравнительная реакционная способность алкенов в реакциях АЕ:
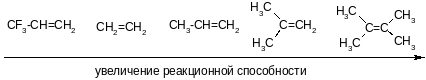
2. Реакции радикального присоединения (АR).
3. Реакции аллильного замещения

4. Окисление
а) эпоксидирование
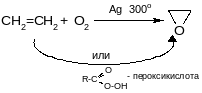
б) гидроксилирование (реакция Вагнера)
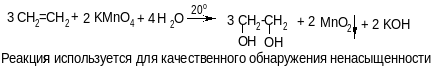
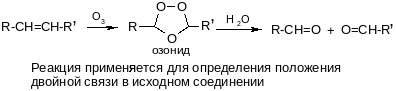
в) озонолиз
г) жесткое окисление
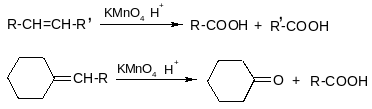
5. Восстановление
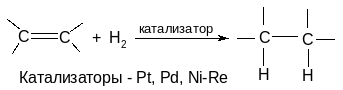
Многие алкены являются ценным сырьем для промышленного органического синтеза. Этилен служит исходным сырьем для получения этанола, ацетальдегида, укс кисл, этиленоксида,этиленгликоля,дихлорэтана, винилхлорида, винилацетата, полиэтилена.
№20
1. Реа р зам (SR) на примере нитрования алк. Тип частиц. Механизм реа и её закономерности.
2. Алкины: строение, физ и хим свойа, практическое значение.3.
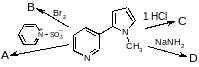
Радикал – электронейтральная частица, атакует неполярные и малополярные связи.
б) нитрование:
в паровой фазе при 400-500о;
жидкофазное – при 110-140о (Коновалов)
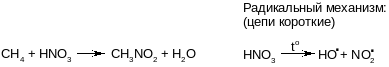
2)алкины

Первые представители- ацетилен,пропин, бутин-1- бесцветные газы, бутин-2 жидк,алкины с числом атомов от С4до С16 жидк, с С17-тв вещ.они нерастворимы в воде, растворимы в малополярных растворителях.
При меняются в промышленности,например ацетилен для резки и сварки металлов и является исходным продуктом для многих хим производств: ацетальдегид, укс кисл и тд.
Химические свойства алкинов
1. Гидрирование
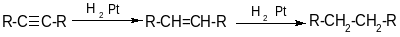
Тройная связь гидрируется легче, чем двойная.
2. Окисление

Обесцвечение раствора KMnO4 – качественная реакция на тройную связь.
3. Реакции присоединения
а) Электрофильное присоединение
Механизм реакции такой же, как для алкенов, но реакционная способность у алкинов меньше – sp-гибридизованный атом углерода имеет бỏльшую электроотрицательность, прочнее удерживает π-электроны, и электрофильная атака затруднена.
Присоединение галогенов
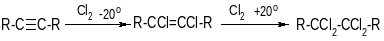
Реакцию можно остановить на 1-й стадии (эквимолярное количество галогена, низкая температура).
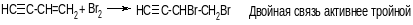
Присоединение галогеноводородов идет по правилу Марковникова
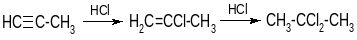
б) Нуклеофильное присоединение
Тройная связь активируется ионами Hg2+ или Cu+
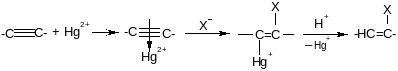
По такому механизму идет, в частности, реакция Кучерова:
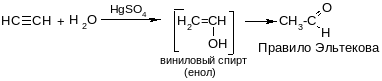
Эта реакция используется как промышленный способ получения ацетальдегида и уксусной кислоты.
Реакции винилирования:
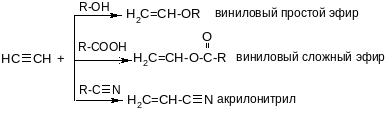
Эти реакции идут в присутствии солей Hg2+ или Cu+.
Поливинилбутиловый эфир – винилин, бальзам Шостаковского. Винилацетат, акрилонитрил – мономеры для широко используемых полимеров.
4. Кислотные свойства.C-sp более электроотрицателен, чем C-sp3 и C-sp2, связь ≡С-Н значительно более полярна, чем связи –СН2-Н и =СН-Н. Поэтому в соединениях, содержащих ≡С-Н, протон может отрываться под действием сильных оснований с образованием аниона ≡С(-):
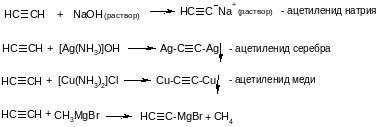
Ацетилениды разлагаются водой с выделением ацетилена. Ацетилениды тяжелых металлов взрывчаты при ударе.
5. Присоединение к карбонильным соединениям

Б21
1. Ря электрофильного присоединения (АЕ) на примере гидратации алкенов. Тип активных частиц. Механизм реакции и её закономерности. 2. Арены
(ароматические углеводороды): строение,хим св.
Активные частицы – это частицы, обладающие высокой химической активностью, они инициируют реакцию.
