
- •1)Типы химических связей в органических соединениях
- •2)Характеристика соединений с поляризованной связью.
- •3)Виды изомерии в органических соединениях
- •4)Предельные углеводороды, их химические свойства.
- •5)Получение алканов.
- •6)Галогенопроизводные углеводородов
- •7)Алкены и их химические свойства.
- •8)Диеновые углеводороды. Особенности реакции присоединения в зависимости от положения двойных связей.
- •9)Алкины. Ацетилен и его химические свойства.
- •10)Получение непредельных углеводородов.
- •11)Качественные реакции на двойную, тройную связь.
- •12)Ароматические соединения. Бензол и его химические свойства
- •13)Гомологи бензола. Получения и свойства.
- •14)Особенности замещения в бензольном кольце. Правило ориентации второго заместителя
- •15)Механизм нитрования бензола.
- •16)Спирты одноатомные и многоатомные. Первичные, вторичные и третичные спирты. Получение спиртов.
- •17)Химические свойства спиртов.
- •18)Двухатомные и трёхатомные спирты.
- •19)Фенолы и их свойства.
- •20)Получение фенолов. Кислотные свойства фенолов
- •21)Альдегиды и их химические свойства.
- •22)Получение альдегидов.
- •23)Полимеризация и конденсация альдегидов.
- •24)Кетоны. Получение и химические свойства.
- •25)Общность и различие химических свойств альдегидов и кетонов.
- •26)Одноосновные карбоновые кислоты. Способы получения кислот.
- •27)Химические свойства одноосновных предельных кислот.
- •28)Непредельные кислоты и их химические свойства.
- •29)Дикарбоновые кислоты.
- •30)Цис - транс - изомерия.
- •31)Гидроксикислоты. Их химические свойства. Оптическая изомерия.
- •3 2)Кетокислоты. Кето — енольнаятаутометрия.
- •33)Высшие предельные и непредельные жирные кислоты. Понятие о незаменимых кислотах.
- •34)Получение простых эфиров и сложных эфиров.
- •35)Сложные эфиры. Реакции этерификации и гидролиза.
- •36)Строение триглицерида. Омыление жира. Гидрогенизация жира. Прогоркание жира. Мыла растворимые и нерастворимые.
- •37)Фосфолипиды Строение серинфосфатида, лецитина и кефалина.
- •38)Стерина и стериды. Химическая структура холестерола.
- •39)Использование магнийорганических соединений для получения различных органических соединений.
- •40)Пентозы. Строение рибозы, дезоксирибозы, ксилозы и арабинозы.
- •41)Гексозы. Строение глюкозы, галактозы, маннозы, фруктозы.
- •42)Циклическое строение моносахаридов.
- •43)Понятие об ассиметрическом атоме углерода. Зеркальная изомерия.
- •44)Восстанавливающие дисахариды.
- •45)Полисахариды. Схема строения крахмала и клетчатки.
- •46)Химические свойства моносахаров.
- •49)Моноаминодикарбоновые и диаминомонокарбоновые кислоты.
- •50)Циклические аминокислоты. Понятие о незаменимых аминокислотах.
- •51)Химические свойства аминокислот.
- •52)Строение белковой молекулы (первичная, вторичная, третичная, четвертичная структуры).
- •53)Ди - и трипептиды.
- •54)Пиримидиновые основания.
- •55)Пуриновые основания.
- •56)Нуклеозиды и нукпеотиды.
- •57)Пуриновые нуклеотиды.
- •58)Пиримидиновые нуклеотиды.
- •59)Схема строения рнк и днк.
- •60)Хромопротеиды. Структура гема.
9)Алкины. Ацетилен и его химические свойства.
CnH2n-2 . Простейший алкин ацетилен, СН≡СН - ацетилен (этин ); CH3-С≡СН - метилацетилен (пропин)
CH3-CH2-С≡СН - бутин-1 (этилацетилен) CH3-С≡С-CH3 -диметилацетилен(бутин-2)
CH3-CH2-СН2-С≡СН,пентин-1
1) Реакции присоединения ,идут за счет разрыва пи-связей,
1,Постепенное присоединение
СН≡СН + H2 →СH2=CH2 + H2 СH3-CH3
2. Галогенирование (например реакция обесцвечивание бромной воды).
СН≡СН + Br2 →СHBr=CHBr
(1,2-дибромэтен) + Br2 СHBr2-CHBr2
1,1,2,2-тетрабромэтан
3.присоединение воды(реакция Кучерова) СН≡СН + H2O →СH2=CH-OH( виниловый спирт) →СH3-COH уксусный альдегид(ацетальдегид)
2)Окисление. а)горение СН≡СН + О2 →СО2 + H2O+Q;
Б)каталитическое
СН≡СН
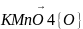 НOOC-COOН
щавелевая кислота
НOOC-COOН
щавелевая кислота
3)Р-ии полимеризации. (димерилизация в-ва-это два одинаковых в-ва) СН≡СН + СН≡СН →СH2=CH-СС≡Н (СH2=CHвинил-радикал, С≡СНацителен) Тримеризация-присоединение трех одинаковых молеккул 3СНСН С6H6(бензол) замкнут≡ая цепочка углеводо родов. ≡
Полимеризация -n СНСН →(СH=CH-)nполиацетелен-чередование двойной и одинарных связей
4)р-ции замещения это качественная реакция на тройную связь а)р-ия серебряного зеркала(красно коричневый осадок) СH≡СН + Ag2О →Ag-C≡С-Ag + H2О(ацетилен серебра) б)СH≡СН + 2CuCl =( NH4ОН) →Cu-C≡С-Cu + 2NH4Cl+Н2О
10)Получение непредельных углеводородов.
Алкинов1) из алканов при высокой температуре (1200 -1500о)метан,этан
2CH4 CH≡СН + 3H2 2C2H6 CH≡СН + 2H2
2) из дигалагенопроизводных CH2Cl-CH2Cl =(NaOH/t*) CH≡CH + 2НCl 3) из карбида кальция СаС2(карбит кальция) + Н2О C2H2 + Ca(OH)2гашенная известь4) Разложением ацетиленидов кислотами СаС2 + 2HCl C2H2 + CaCl2
Алкенов.1) из алкановCH3-CH2-CH3=(t*,кат)CH3-CH=CH2 + H2(I) 2)из галагенопрозводныхалканов При этом соблюдается правило Зайце ва(.отщепление атома водорода в реакциях происходит преимущественно от наименее гидрогенизиро ванного атома углерода[
CH3-CH2Br + KOH =(t) CH2=CH2 + KBr + H2O3)
издигалагенопрозводныхалкановCH2Br-CH2Br + ZnCH2=CH2 + ZnBr2 4)изспиртовCH3-CH2-OH(этанол)=(t*,Н2SО4) CH2=CH2 + H2OАлкодиенов 1) изалканов(бутан) CH3-CH2-CH2-CH3 =(t*,кат)_ СH2=CH-CH=CH2 + 2H2(I) (бутандиен) 2)изэтиловогоспирта2C2H5OH =(t*)_ СH2=CH-CH=CH2 + H2 (I)+ 2H2O
11)Качественные реакции на двойную, тройную связь.
На двойную связь а)обесцвечивание бромной водыCH2=CH2 + Вr2 →СH2Br-CH2Br (1,2-дибромэтан) б) Обесцвечивание перманганата калия в водной и кислой среде при пропускании через неё алкена.(окисление алкенов) CH2=CH2(этилен) =( KMnO4,НОНводный раствор,{O}=CH2OH-CH2OH этандиол(этиленгликоль),
На тройную связь а)р-иис хлоридом меди CuCl+H-C ≡C-H+СuСl= Сu-C ≡C-Cu+HСl (ацетилинит меди) коричневое окрашивание. Б)галагинирование (реакция обесцвечивание бромной воды).СН≡СН + Br2 СHBr=CHBr(1,2-дибромэтен) + Br2 СHBr2-CHBr2
1,1,2,2-тетрабромэтан
12)Ароматические соединения. Бензол и его химические свойства
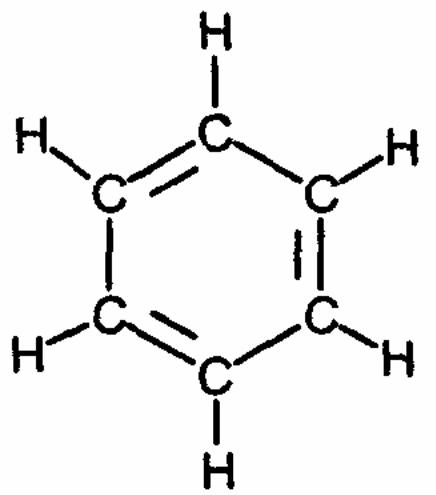
Арены - это циклические соединения, в молекулах которых содержатся одно или несколько ядер бензола. Эмпирическая формула бензола С6Н6, а его структурная
формула может быть изображена одним из способов
,
,
![]()
![]()
Хим. Св-ва. 1) Реакции замещения.сущ-ют различные заместите ли(ориентанты)первого и второго порядка. А)Ориентанты первого порядка –радикалы, галогены, ,гедроксо- и аминогруппы(HCl –OHNH2) Являются донорами электронов, вступая в реакцию реагент направляется в орто- или паро- положение.
(метил бензол)
(ортонитротолуол)
(ортонитрометилбензол)
Б)Ориентанты второго порядка -NO2(нитрогруппа) –COH (альдегидная гр.) –COOH (карбоксильная гр.) SO3 (сульфогруппа).Вступая в реакцию направляются метаположение , акцепторы электронов.
(нитро бензол)
(метанитробензол)
В)Реакции замещения в боковой цепи: без катализа но при нагревании C6H6 + Br2 HBr + C6H5Br бромбензол
2) Реакции нитрования бензола, энергично протекает с большим выходом продуктов, если используется нитрующая смесь,:азотная+серная кислота.
2Н2SO4+HNO3=NO2(+)катион нитрония+2H2SO4(-)+Н3О (гидроксоний) Стадии реакции1) +NO2(+)= (пи-комплекс) 2)Кольцо разрушаетсяNO2(+)вытягивает из 6-ти Р-электронов 2 для образования сигма-комплекса
3)протон водорода отрывается от сигма комплекса и идет на связь с амином серной кислоты, что приводит к образованию нитро бензола Н(+)+НSО4(-)=H2SO4+
2)Галоeнированиe бензол протекает лишь в присутствии катализаторов (FeCl3, FeBr3,
AlCl3 ) C6H6 + Br2 HBr + C6H5Br бромбензол
Реакции присоединения. 1)Идут с трудом при определенных условиях. Галогенирование: С6H6 + 3Сl2 =(свет УФ)C6H6Cl6 гексахлорциклогексан (гексахлоран) – инсектицид 2)Присоединение Н2(при определенных условиях) Гидрирование: C6H6 + 3H2 (Ni(+))С6H12 циклогексан
Реакции окисления. (легко гомологи бензола, трудно сам бензол) C6H5CH3 + =(KMnO4) = C6H5COOHбезойная кислота (розовый цвет, при встряхивании обесцвечивается)Не зависимо от радикала все равно будет эта кислота.
