
- •Когерентные волны.
- •2. Интерференция световых волн.
- •3. Дифракция волн.
- •4. Поляризация волн.
- •5. Дисперсия волн.
- •6. Закон Кирхгофа для теплового излучения.
- •11. Тормозное рентгеновское излучение.
- •12. Фотоэффект и его законы.
- •13. Опыт Боте. Фотоны.
- •16. Постулаты Бора
- •17. Опыты Франка и Герца
- •18. Правило квантования круговых орбит.
- •19. Элементарная Боровская теория водородного атома.
- •20.Гипотеза де – Бройля.
- •22. Уравнение шредингера
- •23. Смысл пси-функции
- •24. Квантование энергии
- •25. Квантование момента импульса
- •26. Принцип суперпозиции
- •28. Квантомеханический гармонический осциллятор
- •30. Спектры щелочных металлов
- •31. Мультиплетность спектра и спин электрона
- •33.Магнитные момент атомов
- •36. Принцип Паули. Распределение электронов в атоме по состояниям
- •37. Периодическая система элементов Менделеева
- •39.Энергия молекулы.
- •55. Термоядерные реакции.
- •59 Систематика элементарных частиц
- •60 Радиационная защита
18. Правило квантования круговых орбит.
В рамках формализма Бора в основу решения проблемы заложено общее выражение для полной энергии электрона в самом общем виде:
![]() (1)
(1)
где в данном конкретном случае q - обобщённая координата точечного электрона на орбите, рассматриваемого как линейный осциллятор, p - его импульс, Т, U - соответственно его кинетическая и потенциальная энергии. В качестве второго моделирующего уравнения используется постулат для отбора квантовых орбит, который является обобщением постулата Планка и который использовался Бором в его базовой работе "О строении атомов и молекул". “Согласно этому последнему постулату из всех возможных состояний линейного осциллятора осуществляются только такие, энергия которых равна
![]() (2)
(2)
Путём стандартных преобразований и замены
![]() (3)
(3)
Шпольский приводит (1) к каноническому виду эллипса
![]() (4)
(4)
и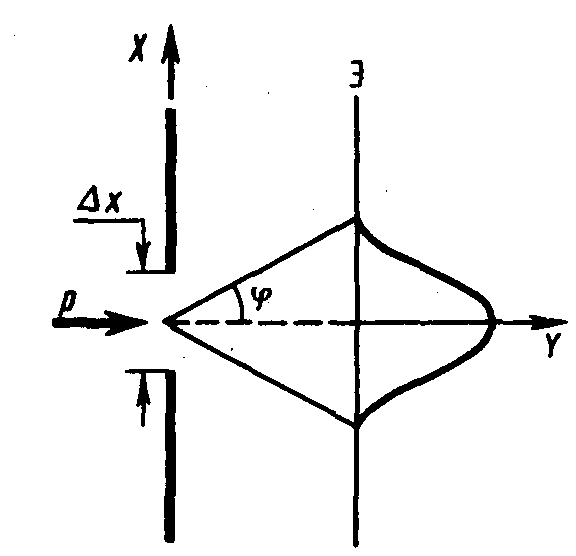 далее вычисляет площадь данной
геометрической фигуры, получая в
результате
далее вычисляет площадь данной
геометрической фигуры, получая в
результате
![]() (5)
(5)
Далее Шпольский переходит от обобщённых координат к координатам, описывающим орбитальное движение электрона, беря в качестве такой координаты полярный угол , характеризующий положение электрона на круговой орбите. При этом
![]() (6)
(6)
откуда
![]() (7)
(7)
Последняя величина является, таким образом, квантовой единицей момента количества движения.
19. Элементарная Боровская теория водородного атома.
Бор предположил, что из всех возможных орбит электрона осуществляются только те. для которых момент импульса равен целому кратному постоянной Планка h, деленной на 2л: mevr = nh (п — 1, 2, 3, ...).(1) Число п называетсяглавным к в а н т о в ы м ч и с л о м.
Рассмотрим электрон, движущийся в поле атомного ядра с зарядом Ze. При Z = 1 такая система соответствует атому водорода, при иных Z — водородоподобному иону. Согласно второму закону Ньютона произведение массы электрона те на его центростремительное ускорение v2/r должно равняться кулоновской силе: те *( υ 2/r)= Ze^2/r^2 (2)
Исключая υ из (1) и (2), получаем, что радиус электронных орбит в атоме может принимать лишь ряд дискретных значений: rn=(h^2*n^2)/(me*Z*e^2) (n= 1, 2, 3, ...). (3)
Для первой орбиты водородного атома (Z = 1, п = 1) получается r1= h^2/(me*e^2)= 0,529 А, (4) т, е. величина порядка газокинетических размеров атома.Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и энергии взаимодействия электрона с ядром (потенциальной энергии): E=(me*υ^2)/2 – (Z*e^2)/r
Из (2) следует, что (me*υ^2)/2 = (Z*e^2)/2r, Следовательно, E=(Z*e^2)/2r - (Z*e^2)/r = - (Z*e^2)/2r
Наконец, учтя значения г, даваемые (3), получим дозволенные значения внутренней энергии атома:
En= - [(me*e^4)/2h^2]*[Z^2/n^2] (n = 1, 2, 3, ...). (5)
При переходе атома водорода (Z = 1) из состояния п в состояние т испускается квант
Hω=- [(me*e^4)/2h^2]*[1/n^2 – 1/ m^2]
Частота испущенного света равна
ω= [(me*e^4)/2h^3]*[1/m^2 – 1/ n^2]
Таким образом, мы пришли к обобщенной формуле Бальмера, при чем для постоянной Ридберга получается значение:
R = (me*e^4)/2h^3 (6)
Если подставить в это выражение значения входящих в него констант, получается величина, хорошо согласующая с экспериментальным значением постоянной Ридберга.
