
- •1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- •2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
- •3. Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей.
- •4. Основные принципы заполнения Атомных Орбиталей электронами. Принцип Паули, правило Хунда.
- •5. Периодическая система элементов (псэ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах псэ.
- •6. Химическая связь: природа, основные виды и свойства.
- •1. Энергия связи.
- •3. Валентный угол.
- •4. Полярность.
- •5. Дипольный момент.
- •7. Валентность, степень окисления атома элемента в химическом соединении.
- •8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
- •9. Ионная связь, ее свойства. Строение и св-ва веществ с ионной связью. Примеры веществ с ионной связью.
- •10. Металлическая связь и ее свойства. Строение и свойства веществ с металлической связью.
- •11. Типы химических превращений. Уравнения химических реакций в ионно-молекулярной форме.
- •12. Основные законы термохимии ( закон Гесса, закон Лавуазье-Лапласа) и следствия из них.
- •13. Стандартная энтальпия образ в-ва (сложного, простого). Теплов эффект хим превращения, расчет.
- •14. Стандартная энтропия вещества (простого, сложного). Расчет изменения энтропии в химической реакции.
- •6 Частиц (6 ионов):
- •15. Опр направления хим р-ции по термодинамич ф-циям состояния. Энергия Гиббса, расчет.
- •16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
- •17. Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
- •18. Равновесие гидролиза солей. По катиону,по аниону, рН водных р-ров солей, константа гидролиза.
- •19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
- •20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
- •22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
- •23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
- •24. Комплексные соединения. Типичные комплексообразователи и лиганды. Координационное число.
- •25. Константа нестойк. Расчет концентрац ионов ко и лигандов в растворе комплексной соли по Кн.
- •26. Химические свойства комплексных солей
- •27. Растворы. Физико-хим взаимодействия в растворах. Сольватация, гидратация, ассоциация, диссоциация.
- •28. Коллигативные свойства растворов. Осмос. Закон Вант-Гоффа.
- •29. Коллигативные св-ва р-ров. Ткип и Тзамерз р-ров. Следствия из з-на Рауля. Определение состояния вещества в р-ре (электролит, неэлектролит, ассоциат) по коллгативным свойствам.
- •30. Коллоидные растворы. Дисперсные системы, классификация, области их применения.
- •31. Строение мицеллы. Правило Пескова-Фаянса. Адсорбция. Св-ва коллоидных р-ров (агрегативная и кинетическая устойчивость, седиментация, коагуляция, оптические и электрические).
- •32. Методы получения и разрушения коллоидных систем.
- •33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
- •35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
- •36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
- •37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
- •38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
- •39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
- •1) Прямой процесс(работа, т.Е. Получение эл. Тока )
- •2) Обратный процесс(приобретение эл. Энергии (зарядка))
- •2) Обратный процесс
- •40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
- •41. Методы защиты от коррозии. Защитные покрытия, катодная и протекторная защита от коррозии.
- •42. Лантаноиды (4-f элементы). Особенность электронного строения. Лантаноидное сжатие. Лантаноиды с переменной степенью окисления.
- •43. Свойства соединений церия и европия в разных степенях окисления. Получение и области применения.
- •44. Актиноиды (5-f элементы). Особенность электронного строения. Актиноидное сжатие. Изменение степени окисления в ряду актиноидов.
- •45. Свойства урана и его соединений в разных степенях окисления. Получение и области применения.
- •1.Свойства гидроксидов:
- •Гидролиз:
- •46. Свойства тория и его соединений. Получение и области применения.
- •47. Радиоактивность и радиохим превращения веществ. Стабильные и нестабильные изотопы. Применение.
- •48. Основные виды ионизирующего излучения.
- •49. Реакции радиоактивного распада. Период полураспада. Ядерные реакции.
- •50. Современные методы разделения и очистки веществ на примерах очистки воды, воздуха, извлечения и разделения актиноидов. Химические методы, ионообменная сорбция, экстракция.
38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
Гальванические элементы- устройства, позволяющие получать электрический ток за счёт хим реакции.
ЭДС г.э – это разность потенциалов на электродах источн тока, при условии равновесн и обратимой работы
Iг.э.→0 (хит)Eг.э.=Eкатод-Еанод(равновесные потенциалы)
Iхит→0
ECu/Zn=ECu-EZn=E0Cu+(RT/2F)lnC(Cu2+)-E0Zn-(RT/2F)lnC(Zn2+)= E0Cu-Zn+(RT/2F)ln(C(Cu2+)/C(Zn2+)) (E0Cu-Zn= E0Cu-E0Zn)
Урни-е Нернста для ЭДС г.э.:
Eг.э.= E0г.э+(RT/nF)ln(Ciкатод)/Cjанод), где Ciкатод, Cjанод- концентрации ионов катодной и анодной р-ции; n-число e в токообразующей р-ции; E0г.э-стандартная ЭДС при Ci=Cj=1 моль/л
39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
Обратимые ХИТ(хим. источник тока)- источники, у которых прямая токообразующая р-ция и обратная р-ция потребления энергии представляют один и тот же процесс. Ресурс обратимых хит возобновляем.
Пр: анод(-)Zn|ZnSO4||CuSO4|Cu (+) катод
1) Прямой процесс(работа, т.Е. Получение эл. Тока )
анод Zn0-2e→Zn+2
катод Cu2++2e→Cu0 Zn+Cu2+→Zn2++Cu0 ∆GI<0, ∆EI>0
2) Обратный процесс(приобретение эл. Энергии (зарядка))
На Электроды г.э. от внешнего источника тока подают потенциалы превышающие равновесные, и заставляющие идти процессы в обратном направлении.
на Zn: Zn2++2e→Zn0
на Cu: Cu0-2e→ Cu2+
Zn2++Cu0→ Zn0+ Cu2+ ∆GII>0, ∆GII=-∆GI,EII=-EI
Пр: свинцовый кислотный аккумулятор EII=-EI
Схема: анод(-) Pb|H2SO4|PbO2 (+)катод
Pb+PbO2+2H2SO4↔2PbSO4+2H2O (в теории выдержит 100÷300 циклов но на практике не больше 60)
Необратимые ХИТ- такие источники тока у которых прямая токобразующая р-ция и обратная р-ция потребления хим энергии не соответствуют друг другу. Расходуются электроды и ресурс таких источников тока не возобновляется.
анод(-)Zn|CuSO4|Cu(+)катод
1) прямой процесс(генерация эл. тока)
анод: Zn-2e→Zn2+
катод: Cu2++2e→Cu0 ∑ Cu2++Zn→Cu0+Zn2+ CuSO4+Zn=Cu+ZnSO4, ∆Gовр<0
2) Обратный процесс
на Zn: Cu2++2e→Cu0
на Cu: Cu0-2e→Cu2+ ∑ Cu2++Cu0→ Cu2++Cu0, ∆GII≠-∆GI, EII≠-EI
Схема мраганцово-цинкового г.э
![]()
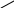 С
Zn+2MnO2+2NH4Cl→ZnCl2+Mn2O3+2NH3↑+H2O
С
Zn+2MnO2+2NH4Cl→ZnCl2+Mn2O3+2NH3↑+H2O
Zn (-)
 анод
анод
NH4Cl+крахмал
40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
Коррозия Ме- это процесс разрушения материалов (Ме, пластмасса) в результате физико-хим воздействия со средой.
Хим коррозия Ме- это процесс разруш Ме под действием окислителей в средах, не проводящ электрич ток.
Скорость хим коррозии определяется скоростью проникновения или диффузии окислителя среды через поверхностную пленку продуктов коррозии к слоям чистого Ме. Ме которые образуют защитную пленку называются коррозивно стойкими. Электрохим коррозия возникает в средах с ионной проводимостью, за счет образования гальванических микроэлементов и протекания электрического тока.
Среды ионной проводимости: 1. Технологические р-ры электролитов.
2. Природные среды(водные, влажный воздух).
Электрохим коррозия возникает в средах с ионной проводимостью при наличии контакта разнородных Ме или Ме с НеМе в результате образования гальванического эл-та. При электрохим коррозии происходит разрушение(окисление) более активного Ме(с меньшим Е), за счет восстановления окислителя среды на участках менее активн Ме или НеМе. Скорость растворения при электрохим коррозии более активного Ме ↑, а скорость растворения менее активного Ме ↓.
При контакте Fe с более активным Ме(Zn) разрушается более активный Ме, а Fe остается в защите.
При контакте Fe с менее активным Ме(Sn) при коррозии будет разрушаться само Fe.
