
- •1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- •2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
- •3. Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей.
- •4. Основные принципы заполнения Атомных Орбиталей электронами. Принцип Паули, правило Хунда.
- •5. Периодическая система элементов (псэ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах псэ.
- •6. Химическая связь: природа, основные виды и свойства.
- •1. Энергия связи.
- •3. Валентный угол.
- •4. Полярность.
- •5. Дипольный момент.
- •7. Валентность, степень окисления атома элемента в химическом соединении.
- •8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
- •9. Ионная связь, ее свойства. Строение и св-ва веществ с ионной связью. Примеры веществ с ионной связью.
- •10. Металлическая связь и ее свойства. Строение и свойства веществ с металлической связью.
- •11. Типы химических превращений. Уравнения химических реакций в ионно-молекулярной форме.
- •12. Основные законы термохимии ( закон Гесса, закон Лавуазье-Лапласа) и следствия из них.
- •13. Стандартная энтальпия образ в-ва (сложного, простого). Теплов эффект хим превращения, расчет.
- •14. Стандартная энтропия вещества (простого, сложного). Расчет изменения энтропии в химической реакции.
- •6 Частиц (6 ионов):
- •15. Опр направления хим р-ции по термодинамич ф-циям состояния. Энергия Гиббса, расчет.
- •16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
- •17. Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
- •18. Равновесие гидролиза солей. По катиону,по аниону, рН водных р-ров солей, константа гидролиза.
- •19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
- •20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
- •22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
- •23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
- •24. Комплексные соединения. Типичные комплексообразователи и лиганды. Координационное число.
- •25. Константа нестойк. Расчет концентрац ионов ко и лигандов в растворе комплексной соли по Кн.
- •26. Химические свойства комплексных солей
- •27. Растворы. Физико-хим взаимодействия в растворах. Сольватация, гидратация, ассоциация, диссоциация.
- •28. Коллигативные свойства растворов. Осмос. Закон Вант-Гоффа.
- •29. Коллигативные св-ва р-ров. Ткип и Тзамерз р-ров. Следствия из з-на Рауля. Определение состояния вещества в р-ре (электролит, неэлектролит, ассоциат) по коллгативным свойствам.
- •30. Коллоидные растворы. Дисперсные системы, классификация, области их применения.
- •31. Строение мицеллы. Правило Пескова-Фаянса. Адсорбция. Св-ва коллоидных р-ров (агрегативная и кинетическая устойчивость, седиментация, коагуляция, оптические и электрические).
- •32. Методы получения и разрушения коллоидных систем.
- •33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
- •35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
- •36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
- •37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
- •38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
- •39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
- •1) Прямой процесс(работа, т.Е. Получение эл. Тока )
- •2) Обратный процесс(приобретение эл. Энергии (зарядка))
- •2) Обратный процесс
- •40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
- •41. Методы защиты от коррозии. Защитные покрытия, катодная и протекторная защита от коррозии.
- •42. Лантаноиды (4-f элементы). Особенность электронного строения. Лантаноидное сжатие. Лантаноиды с переменной степенью окисления.
- •43. Свойства соединений церия и европия в разных степенях окисления. Получение и области применения.
- •44. Актиноиды (5-f элементы). Особенность электронного строения. Актиноидное сжатие. Изменение степени окисления в ряду актиноидов.
- •45. Свойства урана и его соединений в разных степенях окисления. Получение и области применения.
- •1.Свойства гидроксидов:
- •Гидролиз:
- •46. Свойства тория и его соединений. Получение и области применения.
- •47. Радиоактивность и радиохим превращения веществ. Стабильные и нестабильные изотопы. Применение.
- •48. Основные виды ионизирующего излучения.
- •49. Реакции радиоактивного распада. Период полураспада. Ядерные реакции.
- •50. Современные методы разделения и очистки веществ на примерах очистки воды, воздуха, извлечения и разделения актиноидов. Химические методы, ионообменная сорбция, экстракция.
35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
Ок.-вос. двойственность–способность одного и того же в-ва, в зависимости от реагентов и от условий проведения реакц, выступать как в роли окислителя, так и в роли восстановителя. В таких в-вах содержится эл-т в промежуточной степ окисл. Ок.-вос. двойственнос характерна для простых в-тв-НемМе.
H2O2+2KI+H2S O4→ I2+2H2O+ K2SO4 , 2I(-) -2e→I2(0) в-ль, 2O (-)+2e→2O2(-2) о-ль. H2 O2 окисл., I(+1)- только восст. Eовр=Eок. Eвос.=(см.табл.)=1,77-0,54> 0 1.→2.
5NaNO2+2KMnO4+3H2SO4разб.→2MnSO4+5NaNO3+K2SO4+3H2O , Eовр=1,51-0.94>0. 1.→2.
восст(+3) только ок.(+7). Mn(+7) +5e→Mn(+2).о-ль N(+3) -2e→N(+5) в-ль
36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
Электрохимические процессы – это процессы взаимного поглощения 2ух форм энергии: хим.и электр. Электродный потенциал-разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом; возникает на границе раздела фаз в условиях протекания равновесной электр. р-ции. Э.п. зависит от хим.природы электрода и электролита, концентрации веществ, участвующих в электр.р-ции; температуры. Э. п. равен эдс электрохим. цепи, составленной из исследуемого и стандартного электродов.
Для водных р-ров в качестве стандартного электрода обычно используют водородный электрод, С(H+)=1моль/л, р(H2)=1атм. E(H2)=0! Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих Э. п., равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение Э. п. наз. стандартным (обозначение E°) E°(ок/вос) – стандартный Э.п. при Cок. и Свос. = 1 моль/л. (относительный). Оно связано со стандартным изменением энергии Гиббса ∆G и константой равновесия Кр электрохим. р-ции ур-нием: -∆G=nFE°=RTlnKp, где F - число Фарадея; п - число электронов, участвующих в р-ции; R - газовая постоянная; Т - абс. т-ра. Зависимость Э. п. от термодинамич. активностей ai участников электрохим. р-ции выражается Нернста уравнение: E=E°(ок/вос)+RT/zF x ln(Cок./Свос.).
37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
Электрод – электронный проводник, нах в контакте с ионным проводником. При погружении Me (НеMe) в р-р электролита на границе раздела фаз возникает скачок потенциала который назыв электродным потенц
Классификация электродов:1-ого рода, 2-ого, ок-вос, ионно-селективные, газовые.
1)Эл. 1-ого рода это Ме или неМе погруженный в р-р собственной соли. Обменивается с электролитом только с катионом или только с анионом.
а)Me электрод: (восс)Zn0|Zn+2SO4(окис) Zn+2+2e→Zn0
Ур-ие Нернста для Me: EZn2+/Zn0=E0Zn2+/Zn0+(RT/ZF)Ln(Cок(Zn2+)/Cвос(Znтв))
EZn/Zn2+=-0,76+(0,0256/2)LnC(Zn2+)
Для Ме-кого электрода: EMeZ+/Me=E0MeZ+/Me+(RT/ZF)LnC(MeZ+)
б)НеМе электрод: (окис)Pt,S|K2S-2 (восс)(чтоб помочь S отдать ел. дописываем Pt, но сам Pt в р-ци не участ)
S0+2e→S-2 ES0/S-2=E0S0/S2++(RT/ZF)Ln(C(Sтв)/C(S-2)); ES0/S-2=-0,46-(0,0256/2)LnC(S2-)
Ур-ние Нернста для НеМе: EA0/AZ-=E0A0/AZ--(RT/ZT)LnC(AZ-)
2)Окислительно-восстановительные электроды- это инертный(пассивный) Ме (Pt),погруженный в р-р электролита содержащий и окислительную и восстановительную форму вещества.
Pt|окис,восс Pt|, Fe2+3(O4)3, Fe+2SO4 Fe3++e→Fe2+
EFe3+/Fe2+=E0Fe3+/Fe2++(RT/ZF)Ln(C(Fe3+)/C(Fe2+))
3)газовые электроды- это инертный Ме (Pt), находящийся в контакте с газом и погруженный р-р, содержащий ион данного газообразного вещества.
В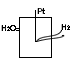 одородный
электрод EH2
=0 Pt,
H2/H+Cl
одородный
электрод EH2
=0 Pt,
H2/H+Cl
PH2=1 атмосфера
2H++2e→H2
EH2=E0+(RT/2P)Ln(C2(H+)/P H2) Учитывая, что E0H2=0
EH2=-0,059pH lgC (H+)=pH ln=2,3Lg
