
- •1. Атом, изотоп, химический элемент, вещество ( простое, сложное, реальное, раствор, смесь).
- •2. Способы выражения состава раствора. Концентрация (молярная, моляльная, массовая доли).
- •3. Квантово-механическая модель атома, квантовые числа, типы атомных орбиталей.
- •4. Основные принципы заполнения Атомных Орбиталей электронами. Принцип Паули, правило Хунда.
- •5. Периодическая система элементов (псэ). Закономерности изменения радиуса атомов химических элементов и электроотрицательности в периодах и группах псэ.
- •6. Химическая связь: природа, основные виды и свойства.
- •1. Энергия связи.
- •3. Валентный угол.
- •4. Полярность.
- •5. Дипольный момент.
- •7. Валентность, степень окисления атома элемента в химическом соединении.
- •8. Ковалентная связь. Насыщаемость, направленность. Строение, структурные формулы. Св-ва веществ.
- •9. Ионная связь, ее свойства. Строение и св-ва веществ с ионной связью. Примеры веществ с ионной связью.
- •10. Металлическая связь и ее свойства. Строение и свойства веществ с металлической связью.
- •11. Типы химических превращений. Уравнения химических реакций в ионно-молекулярной форме.
- •12. Основные законы термохимии ( закон Гесса, закон Лавуазье-Лапласа) и следствия из них.
- •13. Стандартная энтальпия образ в-ва (сложного, простого). Теплов эффект хим превращения, расчет.
- •14. Стандартная энтропия вещества (простого, сложного). Расчет изменения энтропии в химической реакции.
- •6 Частиц (6 ионов):
- •15. Опр направления хим р-ции по термодинамич ф-циям состояния. Энергия Гиббса, расчет.
- •16. Обратимые реакции. Хим равновесие. Закон действующих масс. Константы равновесия
- •17. Равновесие диссоциации слабых к-т и основ. Константа диссоци. З-н разбавления Оствальда. Расчет рН.
- •18. Равновесие гидролиза солей. По катиону,по аниону, рН водных р-ров солей, константа гидролиза.
- •19. Пр малорастворимых соединений . Расчет р-римости соли и концентрации ионов по значению пр.
- •20. Уравнение скорости простой и сложной химической реакции. Порядок и молекулярность реакции.
- •22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
- •23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
- •24. Комплексные соединения. Типичные комплексообразователи и лиганды. Координационное число.
- •25. Константа нестойк. Расчет концентрац ионов ко и лигандов в растворе комплексной соли по Кн.
- •26. Химические свойства комплексных солей
- •27. Растворы. Физико-хим взаимодействия в растворах. Сольватация, гидратация, ассоциация, диссоциация.
- •28. Коллигативные свойства растворов. Осмос. Закон Вант-Гоффа.
- •29. Коллигативные св-ва р-ров. Ткип и Тзамерз р-ров. Следствия из з-на Рауля. Определение состояния вещества в р-ре (электролит, неэлектролит, ассоциат) по коллгативным свойствам.
- •30. Коллоидные растворы. Дисперсные системы, классификация, области их применения.
- •31. Строение мицеллы. Правило Пескова-Фаянса. Адсорбция. Св-ва коллоидных р-ров (агрегативная и кинетическая устойчивость, седиментация, коагуляция, оптические и электрические).
- •32. Методы получения и разрушения коллоидных систем.
- •33. Окислительно-восстановительные сис. Степ окисл. Процессы ок и вос. Пр типичных ок и восстанов.
- •35. Окислительно-восстановительная двойственность на примере н2о2 и NaNo2.
- •36. Электрохимические процессы. Двойной электрич слой на границе электрод/электролит.
- •37. Типы электродов (I рода (Ме и НеМе); газовые электроды (водородный и кислородный); ок-вос электроды). Ур-ние Нернста для электрод потенциала. Стандарт водородный электрод как.
- •38. Гальванические элементы. Электродвижущая сила (эдс) гальванических элементов. Токообразующая реакция гальванических элементов.
- •39. Обратимые гальванические эл-ты (аккумуляторы), необратимые гальванические эл-ты (сухие элементы).
- •1) Прямой процесс(работа, т.Е. Получение эл. Тока )
- •2) Обратный процесс(приобретение эл. Энергии (зарядка))
- •2) Обратный процесс
- •40. Коррозия. Хим и электрохим коррозия Ме. Электрохим коррозия Ме в кислой среде ( Fe/Zn и Fe/Sn).
- •41. Методы защиты от коррозии. Защитные покрытия, катодная и протекторная защита от коррозии.
- •42. Лантаноиды (4-f элементы). Особенность электронного строения. Лантаноидное сжатие. Лантаноиды с переменной степенью окисления.
- •43. Свойства соединений церия и европия в разных степенях окисления. Получение и области применения.
- •44. Актиноиды (5-f элементы). Особенность электронного строения. Актиноидное сжатие. Изменение степени окисления в ряду актиноидов.
- •45. Свойства урана и его соединений в разных степенях окисления. Получение и области применения.
- •1.Свойства гидроксидов:
- •Гидролиз:
- •46. Свойства тория и его соединений. Получение и области применения.
- •47. Радиоактивность и радиохим превращения веществ. Стабильные и нестабильные изотопы. Применение.
- •48. Основные виды ионизирующего излучения.
- •49. Реакции радиоактивного распада. Период полураспада. Ядерные реакции.
- •50. Современные методы разделения и очистки веществ на примерах очистки воды, воздуха, извлечения и разделения актиноидов. Химические методы, ионообменная сорбция, экстракция.
22. Зависимость скорости реакции от температуры ( уравнение Аррениуса, правило Вант-Гоффа).
V большинства хим реакций при увеличении t возрастает, так как увеличивается число активных молекул. Теоретичеки определено, что при увеличении Т на 100С доля активных молекул увеличивается в 2,76 раз. При этом <V> (средняя) возрастает на 2%
Правило Вант-Гоффа (эксперимент зависимость)
При ↑ Т на 100С v химической реакции ↑ в 2-4 раза
![]() - температурный
коэффициент = 2 – 4
- температурный
коэффициент = 2 – 4
![]() - зависимость
Вант-Гоффа
- зависимость
Вант-Гоффа
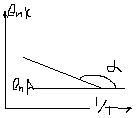
Уравнение Аррениуса
![]() К-константа
скорости, К= V
при СТ=1моль/л
; А-число столкновений ; R-
универсальная газов постоян= 8,314 Дж/моль*К
К-константа
скорости, К= V
при СТ=1моль/л
; А-число столкновений ; R-
универсальная газов постоян= 8,314 Дж/моль*К
Значение зависимости: позволят определить Еа и сделать вывод о механизме процесса
Определение Еа:
Аналитический метод
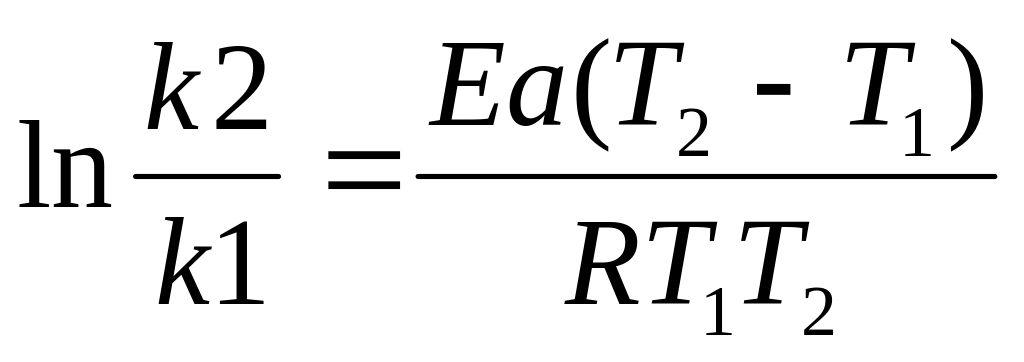
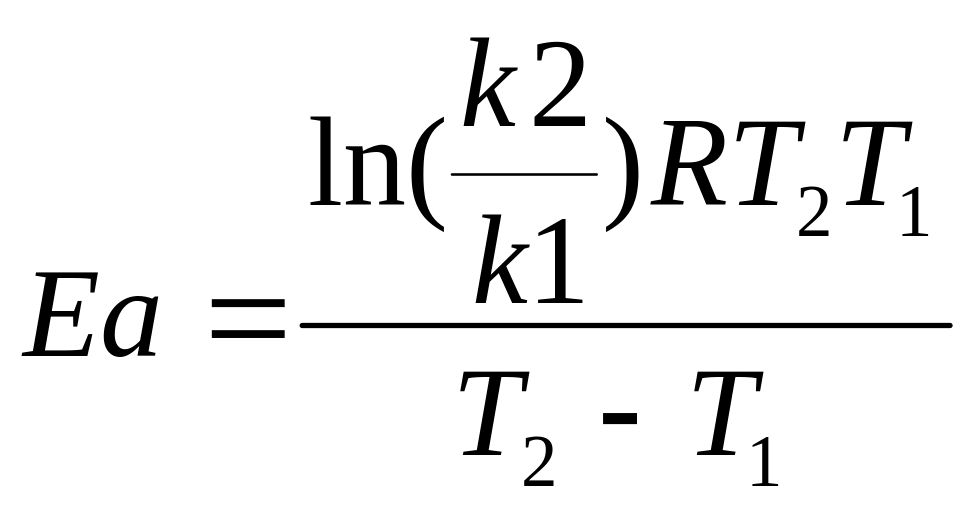
Графический способ ln k=ln A – Еа/ RT (1/T)
23. Катализ. Гомогенный, гетерогенный и ферментативный катализ.
Катализ – это явление изменения скорости или инициирования реакции под действием катализаторов.
- положительный (ускорение); - отрицательный (ингибирование - замедление).
Особенности действия катализатора
Катализаторы –вещества, ускоряющие реакцию, но в результате реакции они не расходуются и не изменяют своё физико-химическое состояние.
1. Катализатор не изменяет начального и конечного состояния системы, не влияет на стехиометрические коэффициенты. ΔНкат = ΔНнекат ΔGкат = ΔGнекат
2. Он не смещает равновесия. Он лишь ускоряет время достижения равновесия.
3. Он создает новый путь процессу,
4. Он снижает Еа, т.к. стадия образования и разложения характерна низкая энергетич активность.
5. Катализатор обладает избирательностью, те есть если в системе протекает несколько реакций, то она выбирает одну.
Виды
1. Гомогенный И катализатор, и в-ва, и продукты – все находятся в однородной фазе (напр в газообразной или жидкой). Реакции гомогенного катализа, как правило, протекают внутри цепных с помощбю радикалов
2. Гетерогенный – катилиз, при котором катализ, реагент, продукты нах не в разных фазах.
Реакции протекают непосредственно на поверхности катализатора и представляют собой сложную реакцию минимум из 5 стадий:
1) Подвод вещества к поверхности
2) Абсорбция веществ на поверхности К – самая важная стадия. Явление поглощения ( или концентрирования ) вещества на поверхности К за счет различных взаимодействий. Роль абсорбции - подготавливать молекулы реагентов к химический реакции. Ослабляет в них связи, приводит их в более активное состояние.
3) Химческая реакция
между веществами, находящимися в
абсорбированном состоянии протекают
быстрее, т.к.
![]() Еа
Еа
4) Десорбация – процесс, обратный абсорбации
5) Отвод продуктов
Чтобы искл влияние 1) и 5) подвод и отвод продуктов осуществляется принудительно с примененимем инертного газа или жидкости.
3. Ферментативный Протекает с участием особых белковых молекул – ферментов. Строение ферментов характеризуется наличием трехмерной полости определенного размера и форм, в которых расположены активные центры.
Особенности ферментного катализа:
1. Высокая избирательность то есть фермент способен взаимодействовать только с тем реагентом, с которым у него комплемертарность
2. Характеризуется резким снижением Еа 40-60 кДж => V увелич в 100-1000 раз
3. Они не подчиняется закону Аррениуса. Наиболее эфеективное действие фермента реакции происходит при t>600C, так как при t>600C разрушаются водородные связи. 90% всех произвольных процессов проводят с участием катализатора.
