
- •Квантово-механическая модель строения атома. Корпускулярно-волновые свойства электрона: уравнение Де Бройля, принцип неопределенности Гейзенберга.
- •Уравнение Шредингера. Квантовые числа, волновая функция, понятие об атомной орбитали.
- •Энергетическая диаграмма возможных состояний электрона в атоме водорода.
- •Распределение электронов по ао в многоэлектронных атомах. Принцип Паули, правило Гунда, правила Клечковского.
- •Периодический закон. Периодическая система. Электронные конфигурации атомов.
- •Периодические свойства атомов (радиусы атомов, энергия ионизации, сродство к электрону, электроотрицательность).
- •Характерные степени окисления элементов.
- •Ковалентная химическая связь: механизмы её образования, разновидности. Длина, энергия, порядок (кратность) ковалентной связи.
- •9, 10. Насыщаемость ковалентной связи и валентные возможности атомов.
- •Полярность и поляризуемость ковалентной связи. Полярность молекулы.
- •Металлическая связь. Деление элементов на металлы и неметаллы. Металлические структуры.
- •Ионная связь и её свойства. Ионные кристаллы.
- •Типы межмолекулярных взаимодействий.
- •Водородная связь и её влияние на физические свойства вещества.
- •Термохимические уравнения. Закон Гесса, следствия из него. Энтальпия.
- •Направление осуществления химических реакций. Энтропия. Энергия Гиббса.
- •Понятие о скорости реакции. Факторы, влияющие на скорость реакции. Влияние концентраций на скорость реакции.
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа, уравнение Аррениуса.
- •Понятие об энергии активации. Гомогенные и гетерогенные катализаторы, каталитические системы, механизм действия катализаторов.
- •Обратимые и необратимые реакции. Химическое равновесие и его признаки. Константа химического равновесия.
- •Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье.
- •Классификация дисперсных систем. Понятие о растворах. Растворимость. Концентрации растворов.
- •Типы гетерогенных дисперсионных систем
- •Процентная концентрация по массе (ω, %)
- •Физико-химические свойства растворов нелетучих веществ (давление насыщенного пара, температура замерзания, температура кипения, осмотическое давление).
- •Понятие об электролитах, степень диссоциации. Растворы сильных электролитов. Ионная сила растворов. Активность ионов.
- •Растворы слабых электролитов. Константа диссоциации слабого электролита. Факторы, влияющие на степень диссоциации слабого электролита.
- •Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
- •Понятие о кислотах. Константы диссоциации слабых кислот. РН в растворах слабых кислот.
- •Понятие об основаниях. Константы диссоциации слабых оснований. РН в растворах слабых оснований.
- •Плохо растворимые электролиты. Произведение растворимости. Условия образования и растворения осадков.
- •Ионно-обменные реакции. Реакция нейтрализации.
- •Гидролиз солей, константа гидролиза. Степень гидролиза и факторы, влияющие на неё.
- •Окислительно-восстановительные реакции (овр). Основные понятия. Направление протекания овр.
- •Понятие об окислительно-восстановительном потенциале (овп). Стандартный водородный электрод. Стандартные овп. Ряд стандартных электродных потенциалов металлов.
- •Факторы, влияющие на величину овп. Уравнение Нернста.
- •Гальванические элементы. Элемент Даниэля-Якоби. Основные типы и области практического использования гальванических элементов.
- •Электролиз расплава соли. Основные понятия. Потенциал разложения. Перенапряжение.
- •Электролиз растворов солей. Ряд разряжаемости катионов и ряд разряжаемости анионов. Области практического применения электролиза. Растворы
- •Химические свойства металлов, взаимодействие металлов с неметаллами.
- •Взаимодействие металлов с водой.
- •Взаимодействие металлов с кислотами.
- •Взаимодействие металлов со щелочами.
- •Классификация неорганических веществ. Кислотно-основные свойства оксидов и гидроксидов металлов.
- •Коррозия металлов. Защита металлов от коррозии.
- •2) Применение коррозионно-стойких материалов.
- •Общая характеристика физических и химических свойств металлов iiа подгруппы. Магний, кальций. Жесткость воды. Умягчение воды.
- •Основные конструкционные металлы - хром, марганец, железо, алюминий. Общая характеристика физических и химических свойств.
- •Полимеры и олигомеры.
- •Химическая идентификация. Аналитический сигнал, химический анализ.
- •Классификация методов качественного анализа
- •Классификация методов количественного анализа
- •Классификация методов титриметрического анализа
- •Теоретические основы кислотно-основного, окислительно-восстановительного титрования. Индикаторы. Принцип их действия.
Понятие о скорости реакции. Факторы, влияющие на скорость реакции. Влияние концентраций на скорость реакции.
Гомогенная система состоит из одной фазы, а гетерогенная – из нескольких фаз. Скоростью гомогенной реакции называется количество вещества, вступающего в реакцию или образующегося в результате реакции, за единицу времени в единице объёма системы. То есть скорость гомогенной реакции (υгомоген) определяется как изменение концентрации (ΔС) реагирующих веществ за единицу времени (Δτ).
υгомоген = ± Δn/(Δτ·V) = ± ΔC/Δτ, [моль/(л·с)], где Δn – количество вещества, моль; Δτ - время реакции, с; V - объем реакционной смеси, л; ΔC - изменение молярной концентрации, [моль/л].
Скоростью гетерогенной реакции (υгетерог) называется количество вещества, вступившего в реакцию или образующегося при реакции за единицу времени на единице площади поверхности раздела фаз:
υгетерог = ±Δn/(Δτ·S), [моль/(с·м2)], где S - площадь поверхности раздела фаз, м2
К важнейшим факторам, влияющим на скорость реакции, относятся следующие: природа реагирующих веществ, их концентрации, температура, природа растворителя, присутствие в системе катализаторов или ингибиторов. Влияние концентрации реагирующих веществ на скорость реакции выражается законом действия масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, в степенях, численно равных коэффициентам в уравнении реакции.
Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа, уравнение Аррениуса.
Зависимость
скорости химической реакции от температуры
выражается правилом
Вант-Гоффа:
при повышении температуры на 10°С скорость
большинства химических реакций
увеличивается в 2-4 раза:
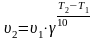 ,
где υ2
и υ1
– скорости реакции при температурах
T2
и T1,
соответственно; γ – температурный
коэффициент скорости реакции (для
большинства реакций он равен от 2 до 4).
Более точно зависимость константы
скорости от температуры описывается
уравнением
Аррениуса:
k
= A·exp-Eа/RT,
где k – константа скорости реакции, А –
предэкспоненциальная постоянная, Ea
– энергия активации для данного процесса,
R
- универсальная газовая постоянная, T
- температура, K.
,
где υ2
и υ1
– скорости реакции при температурах
T2
и T1,
соответственно; γ – температурный
коэффициент скорости реакции (для
большинства реакций он равен от 2 до 4).
Более точно зависимость константы
скорости от температуры описывается
уравнением
Аррениуса:
k
= A·exp-Eа/RT,
где k – константа скорости реакции, А –
предэкспоненциальная постоянная, Ea
– энергия активации для данного процесса,
R
- универсальная газовая постоянная, T
- температура, K.
Понятие об энергии активации. Гомогенные и гетерогенные катализаторы, каталитические системы, механизм действия катализаторов.
Энергия активации – избыточная энергия, которой должны обладать молекулы, для того, чтобы их столкновение могло привести к образованию нового вещества; это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. Катализатор – вещество, которое увеличивает скорость реакции, но при этом не расходуется в результате протекания процесса. В большинстве случаев действие катализатора объясняется тем, что он снижает энергию активации реакции. Реакции, протекающие под действием катализаторов, называются каталитическими. Различают гомогенный и гетерогенный катализ. В случае гомогенного катализа катализатор и реагирующие вещества образуют одну фазу (газ или раствор). В случае гетерогенного катализа катализатор находится в системе в виде самостоятельной отдельной фазы. Ингибитор – замедляет реакцию, в его присутствии энергия активации увеличивается.
