
- •Квантово-механическая модель строения атома. Корпускулярно-волновые свойства электрона: уравнение Де Бройля, принцип неопределенности Гейзенберга.
- •Уравнение Шредингера. Квантовые числа, волновая функция, понятие об атомной орбитали.
- •Энергетическая диаграмма возможных состояний электрона в атоме водорода.
- •Распределение электронов по ао в многоэлектронных атомах. Принцип Паули, правило Гунда, правила Клечковского.
- •Периодический закон. Периодическая система. Электронные конфигурации атомов.
- •Периодические свойства атомов (радиусы атомов, энергия ионизации, сродство к электрону, электроотрицательность).
- •Характерные степени окисления элементов.
- •Ковалентная химическая связь: механизмы её образования, разновидности. Длина, энергия, порядок (кратность) ковалентной связи.
- •9, 10. Насыщаемость ковалентной связи и валентные возможности атомов.
- •Полярность и поляризуемость ковалентной связи. Полярность молекулы.
- •Металлическая связь. Деление элементов на металлы и неметаллы. Металлические структуры.
- •Ионная связь и её свойства. Ионные кристаллы.
- •Типы межмолекулярных взаимодействий.
- •Водородная связь и её влияние на физические свойства вещества.
- •Термохимические уравнения. Закон Гесса, следствия из него. Энтальпия.
- •Направление осуществления химических реакций. Энтропия. Энергия Гиббса.
- •Понятие о скорости реакции. Факторы, влияющие на скорость реакции. Влияние концентраций на скорость реакции.
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа, уравнение Аррениуса.
- •Понятие об энергии активации. Гомогенные и гетерогенные катализаторы, каталитические системы, механизм действия катализаторов.
- •Обратимые и необратимые реакции. Химическое равновесие и его признаки. Константа химического равновесия.
- •Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье.
- •Классификация дисперсных систем. Понятие о растворах. Растворимость. Концентрации растворов.
- •Типы гетерогенных дисперсионных систем
- •Процентная концентрация по массе (ω, %)
- •Физико-химические свойства растворов нелетучих веществ (давление насыщенного пара, температура замерзания, температура кипения, осмотическое давление).
- •Понятие об электролитах, степень диссоциации. Растворы сильных электролитов. Ионная сила растворов. Активность ионов.
- •Растворы слабых электролитов. Константа диссоциации слабого электролита. Факторы, влияющие на степень диссоциации слабого электролита.
- •Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
- •Понятие о кислотах. Константы диссоциации слабых кислот. РН в растворах слабых кислот.
- •Понятие об основаниях. Константы диссоциации слабых оснований. РН в растворах слабых оснований.
- •Плохо растворимые электролиты. Произведение растворимости. Условия образования и растворения осадков.
- •Ионно-обменные реакции. Реакция нейтрализации.
- •Гидролиз солей, константа гидролиза. Степень гидролиза и факторы, влияющие на неё.
- •Окислительно-восстановительные реакции (овр). Основные понятия. Направление протекания овр.
- •Понятие об окислительно-восстановительном потенциале (овп). Стандартный водородный электрод. Стандартные овп. Ряд стандартных электродных потенциалов металлов.
- •Факторы, влияющие на величину овп. Уравнение Нернста.
- •Гальванические элементы. Элемент Даниэля-Якоби. Основные типы и области практического использования гальванических элементов.
- •Электролиз расплава соли. Основные понятия. Потенциал разложения. Перенапряжение.
- •Электролиз растворов солей. Ряд разряжаемости катионов и ряд разряжаемости анионов. Области практического применения электролиза. Растворы
- •Химические свойства металлов, взаимодействие металлов с неметаллами.
- •Взаимодействие металлов с водой.
- •Взаимодействие металлов с кислотами.
- •Взаимодействие металлов со щелочами.
- •Классификация неорганических веществ. Кислотно-основные свойства оксидов и гидроксидов металлов.
- •Коррозия металлов. Защита металлов от коррозии.
- •2) Применение коррозионно-стойких материалов.
- •Общая характеристика физических и химических свойств металлов iiа подгруппы. Магний, кальций. Жесткость воды. Умягчение воды.
- •Основные конструкционные металлы - хром, марганец, железо, алюминий. Общая характеристика физических и химических свойств.
- •Полимеры и олигомеры.
- •Химическая идентификация. Аналитический сигнал, химический анализ.
- •Классификация методов качественного анализа
- •Классификация методов количественного анализа
- •Классификация методов титриметрического анализа
- •Теоретические основы кислотно-основного, окислительно-восстановительного титрования. Индикаторы. Принцип их действия.
Понятие о кислотах. Константы диссоциации слабых кислот. РН в растворах слабых кислот.
Кислота (определение по Аррениусу) – это химическое соединение, которое в водном растворе полностью или частично диссоциирует на положительные ионы водорода и отрицательные ионы кислотного остатка. Концентрация ионов водорода в растворе слабых кислот определяют по закону разведения Оствальда:
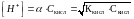 ,где
α – степень диссоциации кислоты, Скисл
– молярная концентрация кислоты, Ккисл
– константа диссоциации кислоты,
характеризует силу кислоты: чем меньше
константа диссоциации, тем слабее
кислота.
,где
α – степень диссоциации кислоты, Скисл
– молярная концентрация кислоты, Ккисл
– константа диссоциации кислоты,
характеризует силу кислоты: чем меньше
константа диссоциации, тем слабее
кислота.
При расчете рН слабых электролитов обычно принимают ионную силу раствора (I) равной нулю, коэффициент активности (f) равным 1 и рН = - lg[H+].
H
NO2
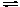 H+
+ NO2–
(слабая кислота - слабый электролит)
H+
+ NO2–
(слабая кислота - слабый электролит)
Понятие об основаниях. Константы диссоциации слабых оснований. РН в растворах слабых оснований.
Основание (определение по Аррениусу) - это химическое соединение, которое в водном растворе частично или полностью диссоциирует на положительно заряженные ионы (простые или сложные) и отрицательно заряженные гидроксид-ионы.
Молярную концентрацию гидроксид – ионов [ОH-] в растворе слабого основания рассчитывают по закону разведения Оствальда:
 ,
где α – степень диссоциации основания,
Сосн
–
,
где α – степень диссоциации основания,
Сосн
–
молярная концентрация основания, Косн – константа диссоциации основания, характеризует силу основания: чем меньше константа диссоциации, тем слабее основание.
pH: Диссоциация слабого основания протекает незначительно, частично:
N
H3∙H2O
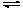 NH4+
+ OH–
(слабое основание - слабый электролит)
NH4+
+ OH–
(слабое основание - слабый электролит)
Плохо растворимые электролиты. Произведение растворимости. Условия образования и растворения осадков.
Насыщенный раствор находится в равновесии с твердой фазой растворяемого вещества. Гетерогенное равновесие «осадок насыщенный раствор» характеризует константа равновесия. Если малорастворимый электролит диссоциирует по уравнению: AmBn mAn+ + nBm-,
то
выражение для константы равновесия –
произведения растворимости (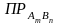 )
– будет иметь вид: Кр
=
= [An+]m·[Bm-]n,
где [An+],
[Bm-]
– молярные концентрации ионов An+
и Bm-,
соответственно, в насыщенном растворе.
Например, для
равновесия: СaSO4
)
– будет иметь вид: Кр
=
= [An+]m·[Bm-]n,
где [An+],
[Bm-]
– молярные концентрации ионов An+
и Bm-,
соответственно, в насыщенном растворе.
Например, для
равновесия: СaSO4
 Ca2+
+ SO42–
Ca2+
+ SO42–
 =
3,72∙10-5
[моль2/л2]
(при 25оС)
=
3,72∙10-5
[моль2/л2]
(при 25оС)
Произведение растворимости (ПР) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
Условие:
Наблюдается следующая закономерность: осадок малорастворимого электролита образуется только тогда, когда произведение концентрации его ионов превышает произведение растворимости (при определенной температуре).
Ионно-обменные реакции. Реакция нейтрализации.
В водных растворах электролитов химические реакции протекают с участием ионов, такие реакции называются ионно-обменными, а уравнения этих реакций – ионными уравнениями.
В ионных уравнениях реакций формулы сильных электролитов записываются в виде ионов, формулы слабых электролитов, осадков и газов – в виде молекул.
Реакциями нейтрализации называются обменные реакции взаимодействия кислот и оснований, в результате которых образуются соль и вода, например: NaOH + HCl = NaCl + H2O или OH – + H+ = H2O
