
- •Квантово-механическая модель строения атома. Корпускулярно-волновые свойства электрона: уравнение Де Бройля, принцип неопределенности Гейзенберга.
- •Уравнение Шредингера. Квантовые числа, волновая функция, понятие об атомной орбитали.
- •Энергетическая диаграмма возможных состояний электрона в атоме водорода.
- •Распределение электронов по ао в многоэлектронных атомах. Принцип Паули, правило Гунда, правила Клечковского.
- •Периодический закон. Периодическая система. Электронные конфигурации атомов.
- •Периодические свойства атомов (радиусы атомов, энергия ионизации, сродство к электрону, электроотрицательность).
- •Характерные степени окисления элементов.
- •Ковалентная химическая связь: механизмы её образования, разновидности. Длина, энергия, порядок (кратность) ковалентной связи.
- •9, 10. Насыщаемость ковалентной связи и валентные возможности атомов.
- •Полярность и поляризуемость ковалентной связи. Полярность молекулы.
- •Металлическая связь. Деление элементов на металлы и неметаллы. Металлические структуры.
- •Ионная связь и её свойства. Ионные кристаллы.
- •Типы межмолекулярных взаимодействий.
- •Водородная связь и её влияние на физические свойства вещества.
- •Термохимические уравнения. Закон Гесса, следствия из него. Энтальпия.
- •Направление осуществления химических реакций. Энтропия. Энергия Гиббса.
- •Понятие о скорости реакции. Факторы, влияющие на скорость реакции. Влияние концентраций на скорость реакции.
- •Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа, уравнение Аррениуса.
- •Понятие об энергии активации. Гомогенные и гетерогенные катализаторы, каталитические системы, механизм действия катализаторов.
- •Обратимые и необратимые реакции. Химическое равновесие и его признаки. Константа химического равновесия.
- •Факторы, влияющие на химическое равновесие. Принцип Ле-Шателье.
- •Классификация дисперсных систем. Понятие о растворах. Растворимость. Концентрации растворов.
- •Типы гетерогенных дисперсионных систем
- •Процентная концентрация по массе (ω, %)
- •Физико-химические свойства растворов нелетучих веществ (давление насыщенного пара, температура замерзания, температура кипения, осмотическое давление).
- •Понятие об электролитах, степень диссоциации. Растворы сильных электролитов. Ионная сила растворов. Активность ионов.
- •Растворы слабых электролитов. Константа диссоциации слабого электролита. Факторы, влияющие на степень диссоциации слабого электролита.
- •Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
- •Понятие о кислотах. Константы диссоциации слабых кислот. РН в растворах слабых кислот.
- •Понятие об основаниях. Константы диссоциации слабых оснований. РН в растворах слабых оснований.
- •Плохо растворимые электролиты. Произведение растворимости. Условия образования и растворения осадков.
- •Ионно-обменные реакции. Реакция нейтрализации.
- •Гидролиз солей, константа гидролиза. Степень гидролиза и факторы, влияющие на неё.
- •Окислительно-восстановительные реакции (овр). Основные понятия. Направление протекания овр.
- •Понятие об окислительно-восстановительном потенциале (овп). Стандартный водородный электрод. Стандартные овп. Ряд стандартных электродных потенциалов металлов.
- •Факторы, влияющие на величину овп. Уравнение Нернста.
- •Гальванические элементы. Элемент Даниэля-Якоби. Основные типы и области практического использования гальванических элементов.
- •Электролиз расплава соли. Основные понятия. Потенциал разложения. Перенапряжение.
- •Электролиз растворов солей. Ряд разряжаемости катионов и ряд разряжаемости анионов. Области практического применения электролиза. Растворы
- •Химические свойства металлов, взаимодействие металлов с неметаллами.
- •Взаимодействие металлов с водой.
- •Взаимодействие металлов с кислотами.
- •Взаимодействие металлов со щелочами.
- •Классификация неорганических веществ. Кислотно-основные свойства оксидов и гидроксидов металлов.
- •Коррозия металлов. Защита металлов от коррозии.
- •2) Применение коррозионно-стойких материалов.
- •Общая характеристика физических и химических свойств металлов iiа подгруппы. Магний, кальций. Жесткость воды. Умягчение воды.
- •Основные конструкционные металлы - хром, марганец, железо, алюминий. Общая характеристика физических и химических свойств.
- •Полимеры и олигомеры.
- •Химическая идентификация. Аналитический сигнал, химический анализ.
- •Классификация методов качественного анализа
- •Классификация методов количественного анализа
- •Классификация методов титриметрического анализа
- •Теоретические основы кислотно-основного, окислительно-восстановительного титрования. Индикаторы. Принцип их действия.
Гальванические элементы. Элемент Даниэля-Якоби. Основные типы и области практического использования гальванических элементов.
Гальванический элемент (ГЭ) - это прибор, в котором химическая энергия окислительно-восстановительной реакции превращается в электрическую. Возьмем два сосуда. В один из них, содержащий раствор ZnSO4 опустим цинковый электрод, в другой, содержащий раствор CuSO4 - медный электрод. Состояние равновесия для обоих электродов выражается уравнением:
Zn Zn2+ + 2 ē (2); Cu Cu2+ + 2 ē (3).
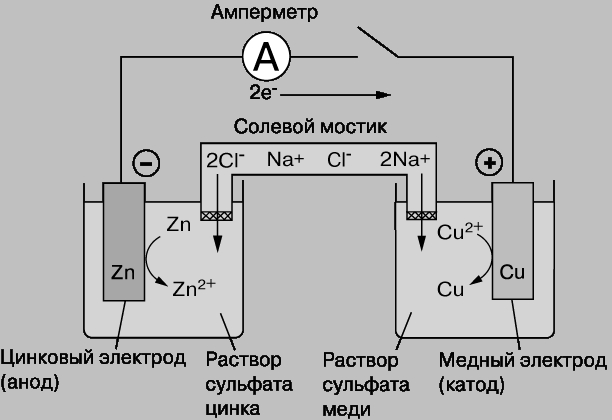
Способность отдавать ионы в раствор у Zn больше, чем у Cu, поэтому концентрация электронов на цинковом электроде больше. Если соединить электроды внешним проводником, а растворы солей электролитическим мостиком, то электроны с цинка будут переходить на медь. Этот переход нарушит равновесие (2) и (3). Происходящие процессы выражаются уравнениями:
Zn0 – 2 ē → Zn2+ - процесс окисления (протекает на аноде);
Cu2+ + 2 ē → Cu0 - процесс восстановления (протекает на катоде).
Анодом является металл с более низким значением электродного потенциала.
Суммарно: Zn0 + Cu2+ → Zn2+ + Cu0
Электродвижущая сила (ЭДС) ГЭ равна разности электродных потенциалов между катодом и анодом.
Гальванические элементы применяют гл. обр. для питания переносной аппаратуры (напр., транзисторных радиоприемников) и поэтому изготавливают преим. с невыливающимся электролитом (загущенным или твердым). В отличие от аккумуляторов, гальванические элементы не нуждаются в особом уходе при эксплуатации.
Электролиз расплава соли. Основные понятия. Потенциал разложения. Перенапряжение.
Электролиз - окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного тока через систему, включающую электролит.
Расплавы
1) Активные металлы
1.Соль активного металла и бескислородной кислоты
NaCl ↔ Na+ + Cl−
K"катод"(-): Na+ + 1e = Na0
A"анод"(+): Cl− — 1e = Cl0; Cl0+Cl0=Cl2
Вывод: 2NaCl → (электролиз) 2Na + Cl2
2.Соль активного металла и кислородосодержащей кислоты
Na2SO4↔2Na++SO42−
K(-): 2Na+ +2e =2Na0
A(+): 2SO42− −4e =2SO3+O2
Вывод: 2Na2SO4 → (электролиз) 4Na + 2SO3 + O2
3. Гидроксид: активный металл и гидроксид-ион
NaOH ↔ Na+ + OH−
K(-): Na+ +1e =Na0
A(+): 4OH− −4e =2H2O + O2
Вывод: 4NaOH → (электролиз) 4Na + 2H2O + O2
2) Менее активные металлы
Точно так же
3) Неактивные металлы
Точно так же
Минимальный потенциал (В), при котором процесс электролиза становится возможным, называется потенциалом (напряжением) разложения. Его находят вычитанием электродного потенциала катиона из соответствующего значения электродного потенциала аниона, единица измерения Вольт (В).
Перенапряжение (ПОЛЯРИЗАЦИЯ) в электрохимии, отклонение значения электродного потенциала от равновесного при пропускании электрич. тока. Величина поляризации зависит от плотности тока i, т.е. силы тока, отнесенной к единице поверхности электрода, и обычно тем больше, чем больше i. При одном и том же значении i поляризация зависит от природы электрода и типа протекающей на его поверхности реакцции, состава раствора, температуры и др. факторов и может колебаться от долей мВ до неск. В. Знак поляризации зависит от направления протекания тока и при изменении направления меняется на обратный.
