- •Вопрос 1.Радиус-вектор.Вектор перемещения.
- •Вопрос 2.Скорость перемещения. Средняя и мгновенная скорости.
- •Вопрос 4.Ускорение.Модуль ускорения.
- •Вопрос 5.Неравномерное движение точки по криволинейной траектории.
- •Тема 5. Законы ньютона.
- •Вопрос 1. Инерциальные системы отсчета. Первый закон Ньютона.
- •Вопрос 2. Второй закон Ньютона.
- •Вопрос 3. Третий закон Ньютона.
- •Вопрос 4. Полный импульс системы.
- •Вопрос 5. Центр масс(центр инерции). Уравнение движения центра масс.
- •Тема 6. Закон сохранения импульса.
- •Вопрос 1. Замкнутая и незамкнутая системы в механике. Закон сохранения импульса.
- •Тема 7. Работа. Мощность. Энергия.
- •Вопрос 1. Определение элементарной работы, различные выражения.
- •Вопрос 2. Мощность, ее выражение через силу и скорость тела.
- •Вопрос 3. Кинетическая энергия и ее выражение через импульс тела.
- •Вопрос 4. Консервативные силы, их работа. Потенциальная энергия.
- •Вопрос 3. Получить выражение для момента инерции.
- •Вопрос 4. Основной закон динамики для вращения тела вокруг неподвижной оси.
- •Вопрос 5. Плоские движения твердого тела.
- •Вопрос 7. Кинетическая энергия при вращательном движении.
- •Тема 9. Закон сохранения момента импульса.
- •Вопрос 1. Получить закон сохранения момента импульса.
- •Тема 10. Силовые поля
- •Вопрос 1. Понятие поля. Поля консервативных сил.
- •Вопрос 2.Потенциальные кривые
- •Вопрос 4.Получить выражение потенциальной энергии
- •Тема 11.Принцип относительности в механике
- •Вопрос 1.Принцип относительности Галилея.
- •Вопрос 2. Постулаты специальной теории относительности(сто).
- •Вопрос 3. Сокращение длины.
- •Вопрос 4. Замедление времени.
- •Вопрос 5. Интервал между событиями.
- •Вопрос 6. Релятивистский закон сложения скоростей.
- •Вопрос 7. Кинетич. Энергия релятивистской частицы. Энергия покоя. Полная энергия.
- •Вопрос 8.Релятивистский Импульс.
- •Вопрос 9.Взаимосвязь массы и энергии в теории относительности.
- •Тема 12. Молекулярная физика.
- •Вопрос 1.Молекулярные системы.
- •Вопрос 2.Идеальный газ
- •Вопрос 3.Основные уравнения мкт
- •Вопрос 4.Средняя кинетическая энергия
- •Вопрос 5.Степени свободы молекул.
- •Тема 13.Классическая статика.
- •Вопрос 1.Распределение молекул по скоростям(Закон Максвелла).
- •Вопрос 2. Средняя арифметическая и средняя квадратичная скорости
- •Вопрос 3.Барометрическая формула. Закон Больцмана.
- •Тема 14. Явления переноса в газах
- •Вопрос 1.Столкновение молекул.
- •Вопрос 2.Диффузия.
- •Вопрос 3.Вязкость (внутреннее трение)
- •Вопрос 4.Теплопроводность
- •Тема 15. Основные понятия термодинамики
- •Вопрос 1. Основные понятия. Обратимые и необратимые процессы.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3.Изохорический процесс. Его можно осуществить, нагревая газ при закрепленном поршне. Подставим выражения для dQ и dU.
- •Вопрос 7.Работа.
- •Вопрос 8.Теплоемкость газов.
- •Тема 16.
- •Вопрос 1. Энтропия
- •Вопрос 2,3,4. Изобарический, изохорический, изотермический
- •Вопрос 6.Теперь мы можем сформулировать II начало термодинамики.
- •Вопрос 7. Круговые процессы (циклы)
- •Тема 18.Вопрос 1.Агрегатные состояния вещества
- •Тема 17.Вопрос 1. Реальные газы
- •Вопрос 2.Состояние реальных газов. Уравнение Ван-дер-Ваальса
- •Вопрос 3. Изотермы реального газа
- •Вопрос 4.Внутреняя энергия реального газа.Эффект джоуля-томсона.
- •Тема 18. Вопрос 2. Жидкости
- •Вопрос 3.
Тема 17.Вопрос 1. Реальные газы
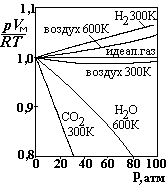
![]() На рис. представлены
кривые для различных газов, показывающие
степень отклонения их от идеальности.
По вертикальной оси отложена безразмерная
величина, pVM/RT,
где VM
- молярный
объем, по горизонтали – давление. При
низких давлениях газы можно считать
идеальными с достаточной степенью
точности. При высоких давлениях
наблюдается значительное отклонение
от идеальности. Ван-дер-Ваальс (1873 г)
внес поправки к уравнению состояния
идеального газа, учитывающие взаимодействие
молекул между собой и собственный объем
молекул, и предложил новое уравнение
состояния. Уравнение Ван-дер-Ваальса
далеко не всегда выполняется для реальных
газов, но оно ценно тем, что по измеренным
величинам p,
V,
T
можно оценить размер молекул и силу их
взаимодействия.
На рис. представлены
кривые для различных газов, показывающие
степень отклонения их от идеальности.
По вертикальной оси отложена безразмерная
величина, pVM/RT,
где VM
- молярный
объем, по горизонтали – давление. При
низких давлениях газы можно считать
идеальными с достаточной степенью
точности. При высоких давлениях
наблюдается значительное отклонение
от идеальности. Ван-дер-Ваальс (1873 г)
внес поправки к уравнению состояния
идеального газа, учитывающие взаимодействие
молекул между собой и собственный объем
молекул, и предложил новое уравнение
состояния. Уравнение Ван-дер-Ваальса
далеко не всегда выполняется для реальных
газов, но оно ценно тем, что по измеренным
величинам p,
V,
T
можно оценить размер молекул и силу их
взаимодействия.
В настоящее время в качестве уравнения состояния чаще всего используется уравнение, называемое вириальным разложением.
Коэффициенты B,C,D,… вириальные коэффициенты.
Вопрос 2.Состояние реальных газов. Уравнение Ван-дер-Ваальса
Из вириального уравнения с одним коэффициентом В можно получить уравнение Ван-дер-Ваальса.
|
уравнение Ван-дер-Ваальса
|
|
|
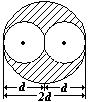
Поправка на собственный объем молекул. Заштрихованный объем – объем недоступности– он в 4 раза больше объема молекулы («1/2», так как нельзя учитывать одну и ту же молекулу дважды), d- диаметр молекулы,
|
|
|
Поправка к давлению, учитывающая взаимодействие молекул между собой. р называют собственным давлением молекул. Молекулы реального газа из-за взаимодействия как бы сами себя сжимают. |
|
|
При такой записи уравнения Ван-дер-Ваальса видно, что давление на стенки в случае реального газа меньше, чем для идеального. Число ударов о стенку пропорционально концентрации молекул в сосуде n. При ударе одной молекулы на нее действует притяжение всех остальных молекул, ослабляя удар. Следовательно, давление ослабляется пропорционально n2 = (N/V)2 1/V2 . |
|
Вопрос 3. Изотермы реального газа
Н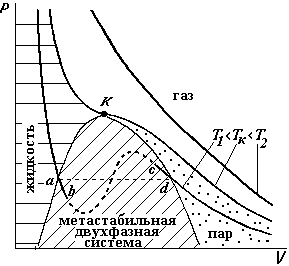 а
рисунке приведены три изотермы,
вычисленные по уравнению Ван-дер-Ваальса.
При высоких температурах (Т2)
кривая аналогична гиперболической
изотерме идеального газа. При низких
температурах (Т1)
кривая имеет изгибы abcd,
(т.к. это уравнение третьей степени по
V).
Изотерма Тк
имеет
один перегиб. Эту температуру называют
критической температурой. Экспериментально
полученные изотермы для различных газов
имеют такой же характер, за исключением
участка abcd.
При этом в области правее критической
изотермы вещество находится в газообразном
состоянии. Левее точки d,
(заштрихованная колоколообразная
область) начинается частичная конденсация
газа и образуется неустойчивая двухфазная
система газ-жидкость.3
Левее этой области газ переходит в
жидкое состояние. Экспериментально
весь участок abcd
получить нельзя. При очень тщательном
проведении эксперимента можно получить
небольшие участки ab
(перегретая жидкость) и cd
(перегретый пар). Если газ находится при
температуре Т
Тк,
то никаким сжатием его невозможно
перевести в жидкое состояние. Но если
газ охладить до
Т
Тк,
то простым сжатием его можно превратить
в жидкость. Поэтому в области левее от
Тк,
а
рисунке приведены три изотермы,
вычисленные по уравнению Ван-дер-Ваальса.
При высоких температурах (Т2)
кривая аналогична гиперболической
изотерме идеального газа. При низких
температурах (Т1)
кривая имеет изгибы abcd,
(т.к. это уравнение третьей степени по
V).
Изотерма Тк
имеет
один перегиб. Эту температуру называют
критической температурой. Экспериментально
полученные изотермы для различных газов
имеют такой же характер, за исключением
участка abcd.
При этом в области правее критической
изотермы вещество находится в газообразном
состоянии. Левее точки d,
(заштрихованная колоколообразная
область) начинается частичная конденсация
газа и образуется неустойчивая двухфазная
система газ-жидкость.3
Левее этой области газ переходит в
жидкое состояние. Экспериментально
весь участок abcd
получить нельзя. При очень тщательном
проведении эксперимента можно получить
небольшие участки ab
(перегретая жидкость) и cd
(перегретый пар). Если газ находится при
температуре Т
Тк,
то никаким сжатием его невозможно
перевести в жидкое состояние. Но если
газ охладить до
Т
Тк,
то простым сжатием его можно превратить
в жидкость. Поэтому в области левее от
Тк,
выделена область «пар», хотя это такое же газообразное состояние.
КРИТИЧЕСКОЕ СОСТОЯНИЕ
На рисунке на критической изотерме указана точка К – это критическая точка, ей соответствуют критические параметры pk , Vk и Тk.. Так как это точка перегиба, то для нее первая и вторая производные должны быть равны нулю.
|
запишем уравнение Ван-дер-Ваальса в указанном виде, V VM – молярный объем |
|
|
из этих уравнений, разделив первое уравнение на второе, найдем выражение для критического объема Vk |
|
|
||
|
критические параметры
|
подставив Vk в (2), получим критическую температуру Тk ; подставив Vk и Тk в (1) и найдем критическое давление рк |
Каждое вещество имеет определенные значения критических параметров. Критическая температура – это такая температура, при которой исчезает разница между жидким и газообразным состоянием. Для гелия Тк 269 оС, для воды Тk. 374 Со, pk 218 атм. Опыты по определению критических параметров представляют собой большие трудности. Участок вблизи критической точки – это почти горизонтальная прямая, поэтому при значительном изменении объема давление меняется очень мало. Можно провести такой качественный опыт. Заполнить примерно на одну треть стеклянную ампулу с жидким эфиром и запаять ее. При этом четко видна граница жидкости. Если нагревать ампулу, то при температуре около 180 оС граница мгновенно исчезает и содержимое ампулы становится молочно белого цвета, это и есть переход в критическое состояние.
Определение параметров критического состояния имеет большое значение при исследовании веществ. Если для исследуемого вещества выполняется уравнение Ван-дер-Ваальса, то измеряя опытным путем pk , Vk и Тk., можно найти поправки a и b и получить сведения о свойствах молекул – их объеме и взаимодействии. При использовании вириального уравнения, коэффициенты В и С также связаны со свойствами молекул.