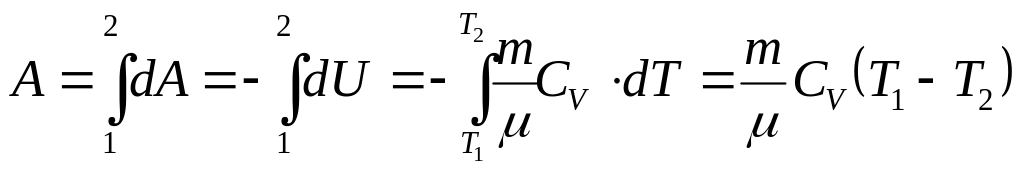- •Вопрос 1.Радиус-вектор.Вектор перемещения.
- •Вопрос 2.Скорость перемещения. Средняя и мгновенная скорости.
- •Вопрос 4.Ускорение.Модуль ускорения.
- •Вопрос 5.Неравномерное движение точки по криволинейной траектории.
- •Тема 5. Законы ньютона.
- •Вопрос 1. Инерциальные системы отсчета. Первый закон Ньютона.
- •Вопрос 2. Второй закон Ньютона.
- •Вопрос 3. Третий закон Ньютона.
- •Вопрос 4. Полный импульс системы.
- •Вопрос 5. Центр масс(центр инерции). Уравнение движения центра масс.
- •Тема 6. Закон сохранения импульса.
- •Вопрос 1. Замкнутая и незамкнутая системы в механике. Закон сохранения импульса.
- •Тема 7. Работа. Мощность. Энергия.
- •Вопрос 1. Определение элементарной работы, различные выражения.
- •Вопрос 2. Мощность, ее выражение через силу и скорость тела.
- •Вопрос 3. Кинетическая энергия и ее выражение через импульс тела.
- •Вопрос 4. Консервативные силы, их работа. Потенциальная энергия.
- •Вопрос 3. Получить выражение для момента инерции.
- •Вопрос 4. Основной закон динамики для вращения тела вокруг неподвижной оси.
- •Вопрос 5. Плоские движения твердого тела.
- •Вопрос 7. Кинетическая энергия при вращательном движении.
- •Тема 9. Закон сохранения момента импульса.
- •Вопрос 1. Получить закон сохранения момента импульса.
- •Тема 10. Силовые поля
- •Вопрос 1. Понятие поля. Поля консервативных сил.
- •Вопрос 2.Потенциальные кривые
- •Вопрос 4.Получить выражение потенциальной энергии
- •Тема 11.Принцип относительности в механике
- •Вопрос 1.Принцип относительности Галилея.
- •Вопрос 2. Постулаты специальной теории относительности(сто).
- •Вопрос 3. Сокращение длины.
- •Вопрос 4. Замедление времени.
- •Вопрос 5. Интервал между событиями.
- •Вопрос 6. Релятивистский закон сложения скоростей.
- •Вопрос 7. Кинетич. Энергия релятивистской частицы. Энергия покоя. Полная энергия.
- •Вопрос 8.Релятивистский Импульс.
- •Вопрос 9.Взаимосвязь массы и энергии в теории относительности.
- •Тема 12. Молекулярная физика.
- •Вопрос 1.Молекулярные системы.
- •Вопрос 2.Идеальный газ
- •Вопрос 3.Основные уравнения мкт
- •Вопрос 4.Средняя кинетическая энергия
- •Вопрос 5.Степени свободы молекул.
- •Тема 13.Классическая статика.
- •Вопрос 1.Распределение молекул по скоростям(Закон Максвелла).
- •Вопрос 2. Средняя арифметическая и средняя квадратичная скорости
- •Вопрос 3.Барометрическая формула. Закон Больцмана.
- •Тема 14. Явления переноса в газах
- •Вопрос 1.Столкновение молекул.
- •Вопрос 2.Диффузия.
- •Вопрос 3.Вязкость (внутреннее трение)
- •Вопрос 4.Теплопроводность
- •Тема 15. Основные понятия термодинамики
- •Вопрос 1. Основные понятия. Обратимые и необратимые процессы.
- •Вопрос 2. Первое начало термодинамики.
- •Вопрос 3.Изохорический процесс. Его можно осуществить, нагревая газ при закрепленном поршне. Подставим выражения для dQ и dU.
- •Вопрос 7.Работа.
- •Вопрос 8.Теплоемкость газов.
- •Тема 16.
- •Вопрос 1. Энтропия
- •Вопрос 2,3,4. Изобарический, изохорический, изотермический
- •Вопрос 6.Теперь мы можем сформулировать II начало термодинамики.
- •Вопрос 7. Круговые процессы (циклы)
- •Тема 18.Вопрос 1.Агрегатные состояния вещества
- •Тема 17.Вопрос 1. Реальные газы
- •Вопрос 2.Состояние реальных газов. Уравнение Ван-дер-Ваальса
- •Вопрос 3. Изотермы реального газа
- •Вопрос 4.Внутреняя энергия реального газа.Эффект джоуля-томсона.
- •Тема 18. Вопрос 2. Жидкости
- •Вопрос 3.
Вопрос 7.Работа.
Работу,
совершаемую при
адиабатическом процессе
можно найти, проинтегрировав уравнение
I
начала термодинамики:
![]() .
.
|
Работу можно выразить через другие параметры, используя уравнения адиабаты:
|
Пусть газ находится в некотором состоянии с
объемом V. Зададимся вопросом, как выгоднее
проводить (быстро
поднять поршень в цилиндре), расширение газа – адиабатически или
изотермически? Ответ – адиабатически т.к. площадь под
адиабатой меньше. А сжимать газ выгоднее
изотермически (очень медленно).
Вопрос 8.Теплоемкость газов.
 Из приведенных
выше формул следует, что теплоемкость
идеального газа не зависит от температуры
газа, а определяется только числом
степеней свободы молекул. Для многих
одноатомных и двухатомных газов опыт
подтверждает этот вывод для умеренных
температур. Но при низких и высоких
температурах наблюдается характерная
зависимость теплоемкости от температуры.
На графике приведена несколько
идеализированная зависимость молярной
теплоемкости от температуры для
двухатомного газа. Простейшее объяснение
такой зависимости состоит в следующем.
При низких температурах преобладает
поступательное движение молекул. С
ростом температуры все больше молекул
начинают участвовать во вращательном
движении. С дальнейшим повышением
температуры более интенсивно происходят
колебания атомов в молекулах. В
действительности объяснить зависимость
теплоемкости от температуры можно
только на основе квантовой механики.
Из приведенных
выше формул следует, что теплоемкость
идеального газа не зависит от температуры
газа, а определяется только числом
степеней свободы молекул. Для многих
одноатомных и двухатомных газов опыт
подтверждает этот вывод для умеренных
температур. Но при низких и высоких
температурах наблюдается характерная
зависимость теплоемкости от температуры.
На графике приведена несколько
идеализированная зависимость молярной
теплоемкости от температуры для
двухатомного газа. Простейшее объяснение
такой зависимости состоит в следующем.
При низких температурах преобладает
поступательное движение молекул. С
ростом температуры все больше молекул
начинают участвовать во вращательном
движении. С дальнейшим повышением
температуры более интенсивно происходят
колебания атомов в молекулах. В
действительности объяснить зависимость
теплоемкости от температуры можно
только на основе квантовой механики.
Тема 16.
Вопрос 1. Энтропия
II начало термодинамики, как и I начало, является обобщением большого числа опытных фактов и имеет несколько формулировок.
Введем сначала понятие «энтропия», которое играет ключевую роль в термодинамике. Энтропия S – одна из важнейших термодинамических функций, характеризующая состояние или возможные изменения состояния вещества – это многогранное понятие.
1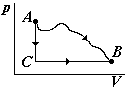 )Энтропия
– это функция состояния.
Введение таких величин ценно тем, что
при любых процессах изменение функции
состояния одинаково, поэтому сложный
реальный процесс можно заменить
«выдуманными» простыми процессами.
Например, реальный процесс перехода
системы из состояния А в состояние В
(см. рис.) можно заменить на два процесса:
изохорический АС
и изобарический СВ.
)Энтропия
– это функция состояния.
Введение таких величин ценно тем, что
при любых процессах изменение функции
состояния одинаково, поэтому сложный
реальный процесс можно заменить
«выдуманными» простыми процессами.
Например, реальный процесс перехода
системы из состояния А в состояние В
(см. рис.) можно заменить на два процесса:
изохорический АС
и изобарический СВ.
Энтропия определяется следующим образом.
|
«Бесконечно малое изменение энтропии равно элементарному количеству теплоты, получаемому системой, отнесенному к температуре, при которой это тепло передается» |
|
|
конечное изменение энтропии. Величину Q/T называют приведенной теплотой, поэтому можно дать такое определение: изменение энтропии равно сумме приведенных теплот. |
|
Для обратимых процессов в идеальных газах можно получить формулы для вычисления энтропии в различных процессах. Выразим dQ из I начала и подставим ввыражение для dS .
|
Интегрируя, получим выражения для изменения энтропии в различных изопроцессах в идеальных газах.