
- •1. Основные положения теории химического строения а.М. Бутлерова. Изомерия.
- •2. Электронное строение атома углерода(самый главный билет в органике,сочувствую,кому это попадется)
- •3. Классификация органических соединений.Функциональные группы.
- •4. Строение,изомерия,номенклатура и способы получения алканов.( можно взять еще инфу из 5 билета)
- •5.Химические свойства алканов.Реакция Коновалова.Применение алканов.(можно взять еще инфу из 4 билета)
- •6.Строение, изомерия,номенклатура,способы получения алкенов.
- •Химическая формула и строение молекулы этилена.
- •Изомерия и номенклатура.
- •Гомологический ряд этилена
- •Получение
- •7.Химические свойства алкенов,правило Марковникова,полимеризация алкенов,применение. Химические свойства
- •Получение.
- •8.Строение,изомерия,номенклатура,способы получения алкинов.
- •9.Химические свойства алкинов. Реакция Кучерова.Полимеризация ацетилена.Применение алкинов.
- •10.Строение,изомерия,номенклатура алкадиенов. Способы получения дивинила и изопрена.Реакция Лебедева.
- •11.Химические свойства алкадиенов с сопряженными связями.Применение алкадиенов.Натуральный и синтетический каучук.Резина.Гуттаперча.
- •12.Строение,изомерия,номенклатура и способы получения алифатических одноатомных спиртов.
- •13.Химические свойства алифатических одноатомных спиртов. Применение спиртов.Этиленгликоль и глицерин.
- •14.Строение,изомерия,номенклатура и способы получения алифатических альдегидов и кетонов.
- •15.Хим.Свойства алифатических альдегидов и кетонов.Реакция серебрянного зеркала.Применение альдегидов и китонов.
- •16.Строение,изомерия,номенклатура,способы получения алифатических одноосновных кислот.
- •17.Химические свойства алифатических одноосновных кислот. Применение кислот.
- •18.Сложные эфиры.Получение и свойства.
- •19.Строение жиров и их переработка. Мыла.Поверхностно-активные вещества.
- •20.Строение,изомерия,номенклатура,способы получения алифатических нитросоединений и аминов.
- •21.Хим.Свойства нистросоединений и аминов.
- •Химические свойства
- •22.Хим.Свойства алифатических аминокислот.Белки.
- •23.Строение,изомерия,номенклатура ароматических углеводородов.Правило ароматичности Хюккеля.
- •24.Химические свойства бензола.
- •25.Правила замещения в бензольном ядре производных бензола.Ориентанты 1 и 2 рода.
- •26.Строение,изомерия,номенклатура,способы получения фенолов.
- •27.Хим.Свойства фенола.Реакции электрофильного замещения,применение фенола в ффс.
- •28.Строение,изомерия,номенклатура,способы получения ароматических аминов. Анилин. Реакция Зинина.
- •29.Основные понятия Химии вмс.Классификация и номенклатура вмс.Методы синтеза вмс в промышленности.
1. Основные положения теории химического строения а.М. Бутлерова. Изомерия.
1. Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается одной структурной формулой (формулой строения).
2. Химическое строение можно устанавливать химическими методами. (В настоящее время используются также современные физические методы).
3. Свойства веществ зависят от их химического строения.
4. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы - предвидеть свойства.
5. Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга.
Теория Бутлерова явилась научным фундаментом органической химии и способствовала быстрому ее развитию. Опираясь на положения теории, А.М. Бутлеров дал объяснение явлению изомерии, предсказал существование различных изомеров и впервые получил некоторые из них.
Развитию теории строения способствовали работы Кекуле, Кольбе, Купера и Вант-Гоффа. Однако их теоретические положения не носили общего характера и служили, главным образом, целям объяснения экспериментального материала.
Изомеры – вещества, которые имеют одинаковый количественный и качественный состав, но различаются строением молекул, а, следовательно, и свойствами. Различают структурную и пространственную (стерео-) изомерию. К первому типу относится
изомерия углеродного скелета (например, н-бутан и изобутан);
изомерия положения кратной связи в молекуле (например, 2-метил-1-бутен и 2-метил-2-бутен);
изомерия положения функциональной группы (например, 1-хлорпропан и 2-хлорпропан);
межклассовая изомерия или метамерия (например, бутин-1 и бутадиен-1,3) и т.д.
В пространственных изомерах порядок связи атомов в молекулах совпадает, а их расположение в пространстве различается, что вызывает различие в свойствах. К пространственной относится геометрическая изомерия. Она возможна, например, у алкенов.
2. Электронное строение атома углерода(самый главный билет в органике,сочувствую,кому это попадется)
Атом углерода состоит из ядра, имеющего положительный заряд +6 (так как содержит шесть протонов), и электронной оболочки, на которой находятся шесть электронов, расположенных на двух энергетических уровнях (слоях):

Реальное строение атома углерода гораздо сложнее, чем представлено на приведенной схеме. Атом углерода имеет два вида орбиталей: s-орбитали сферической формы и р-орбитали в форме гантели или объемной восьмерки. Эти орбитали отличаются друг от друга не только формой, но и удаленностью от ядра атома. Чем более удалена от ядра орбиталь, тем большую энергию имеет электрон на этой орбитали.
Чтобы различать энергетические уровни, их нумеруют в порядке удаления от ядра. Ближайший к ядру — первый (1), затем второй (2) … В атоме углерода первый уровень составляет одна s-орбиталь, на которой находятся два электрона. Второй энергетический уровень атома углерода также содержит s-орбиталь, но большего размера, так как запас энергии электронов на ней выше, чем у электронов первого уровня, а также три р-орбитали. Чтобы представить расположение электронов в атоме, надо помнить, что каждый электрон занимает энергетически наиболее выгодное положение, при котором запас его энергии будет наименьшим. Он всегда стремится занять наиболее близкое к ядру положение и попасть на орбиталь более простой формы (например, сначала на s-, а уж потом на р-орбиталь). Соответственно электронная формула атома углерода будет иметь вид 1s22s22p2. Изобразим электронно-графические формулы атомов углерода и водорода:
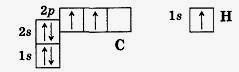
Валентность химического элемента чаще всего определяется числом неспаренных электронов. Атом углерода, как видно из электронно-графической формулы, имеет два неспаренных электрона, поэтому с их участием могут образоваться две электронные пары, осуществляющие две ковалентные связи.
Для образования ковалентной связи необходимо, чтобы ор-биталь одного атома перекрывалась с орбиталью другого. При этом чем больше перекрывание, тем прочнее связь. В молекуле водорода Н2 образование ковалентной связи происходит за счет перекрывания s-орбиталей. Расстояние между ядрами атомов водорода, или длина связи, составляет 7,4 * 10-2 нм, а ее прочность — 435 кДж/моль. Химические связи, образующиеся в результате перекрывания электронных орбиталей вдоль линии связи, называются а-связями (сигма-связями). Линия связи — прямая, соединяющая ядра атомов. Для в-орбиталей возможен лишь единственный способ перекрывания — с образованием а-связей. р-Орбитали могут перекрываться с образованием а-связей, а также могут перекрываться в двух областях, образуя ковалентную связь другого вида — за счет «бокового» перекрывания.
Химические связи, образующиеся в результате «бокового» перекрывания электронных орбиталей вне линии связи, т. е. в двух областях, называются п-связями (пи-связями).
Гибридизация орбиталей — концепция смешения разных, но близких по энергии орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. Гибридизация атомных орбиталей происходит при возникновении ковалентной связи между атомами. Гибридизация орбиталей очень полезна при объяснении формы молекулярных орбиталей и является интегральной частью теории валентных связей.
sp3-Гибридизация (характерна для алканов) гибридизация, в которой участвуют атомные орбитали одного s- и трех p-электронов. Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28' . Пространственная конфигурация молекулы, центральный атом которой образован sp3-гибридными орбиталями – тетраэдр sp2-гибридизация (характерна для алкенов , диенов и аренов) Три sp² орбитали Происходит при смешивании одной s- и двух p-орбиталей. Образуется три гибридные орбитали с осями, расположенными в одной плоскости и направленными к вершинам треугольника под углом 120 градусов. Негибридная p-атомная орбиталь перпендикулярна плоскости и, как правило, участвует в образовании π-связей sp-гибридизация (характерна для алкинов) Происходит при смешивании одной s- и одной p-орбиталей. Образуется две равноценные sp-атомные орбитали, расположенные линейно под углом 180 градусов и направленные в разные стороны от ядра атома углерода. Две оставшиеся негибридные p-орбитали располагаются во взаимно перпендикулярных плоскостях и участвуют в образовании π-связей, либо занимаются неподелёнными парами электронов
