
- •2.Вопрос.(хз может не полный ) Стехиометрические расчеты по уравнениям реакций.
- •3.Вопрос
- •4.Вопрос
- •5.Вопрос.
- •Билет №6
- •Следствия из закона Гесса
- •Билет 9 Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •5.1.3. Принцип Ле Шателье
- •5.2. Химическое равновесие в гетерогенных системах
- •Растворимость
- •Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •1. Теория электрической диссоциации Аррениуса.
- •2. Сильные и слабые электролиты
- •3. Константа диссоциации слабых электролитов
- •4. Закон разбавления Освальда
- •Билет 12
- •1.Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении. Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Сильные электролиты
- •Вывод значения pH
- •Значения pH в растворах различной кислотности
- •5. Различные случаи гидролиза.
- •6. Степень гидролиза и зависимость ее от концентрации и температуры.
- •7.Смещение равновесия гидролиза.
- •13 Билет.
- •По составу
- •По назначению
- •Паста коки
- •Влияние пав на компоненты окружающей среды
- •17 Билет.
- •Химические источники тока.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •3.Концентрационные цепи
- •По значению э. Д. С. Гальванического элемента
- •4.Гальванические элементы с газовыми электродами
- •5. Окислительно-восстановительные
- •6.Аккумуляторы
- •7.Топливные элементы
- •Билет 19 Электролиз как окислительно-восстановительный процесс
- •Популярные места применения керамики
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции (законЛавуазье — Лапласа).
Тепловой эффект химической реакции равен разности сумм теплот образования (ΔHf) продуктов реакции и исходных веществ, умноженных на стехиометрические коэффициенты (ν):
![]()
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ и продуктов реакции, умноженных на стехиометрические коэффициенты (ν):
![]()
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н.стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
Если начальное и конечное состояния химической реакции (реакций) совпадают, то ее (их) тепловой эффект равен нулю.
Термохимические расчеты основаны на применении к химическим процессам соотношений, вытекающих из I начала термодинамики. Термохимические расчеты и расчеты химического равновесия в сколько-нибудь широком интервале температур, как мы видели, требуют знания теплоемкостей участвующих в реакции веществ в функции температуры. Термохимические расчеты часто используются в металлургии. Стандартные теплоты образования некоторых ионов в водном растворе при 298 15 К. Термохимические расчеты для реакций, протекающих в растворах, целесообразно проводить исходя не из теплот образования молекул, а из теплот образования ионов. Однако измерить теплоты образования отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. Электроотрицательности, по Полингу. Термохимические расчеты вслед за Полингом были проведены целым рядом авторов, в результате чего был значительно расширен набор электроотрицательностей. Термохимические расчеты основаны на применении термохимических уравнений, которые представляют собой обычные уравнения химических реакций, когда в них, наряду с формулами веществ, участвующих в реакции, указываются и тепловые эффекты процесса. Термохимические расчеты значительно облегчаются при использовании энтальпийных диаграмм [30 - 32], которые, к сожалению, пока опубликованы только для некоторых систем. Помимо определения тепловых величин энтальпийные диаграммы позволяют рассчитывать и материальный баланс. Ниже рассматриваются примеры их применения для различных случаев кристаллизации. Стандартные теплоты образования некоторых ионов в водном растворе при 298 13 К. Термохимические расчеты для реакций, протекающих в растворах, целесообразно проводить исходя не из теплот образования молекул, а из теплот образования ионов. Однако измерить теплоты образования отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. Термохимические расчеты служат для оценки калорийности топлива, порохов и взрывчатых веществ, используются для оценки возможности протекания той или иной химической реакции в форме горения или взрыва. Термохимические расчеты основаны на применении термохимических уравнений, которые представляют собой обычные уравнения химических реакций, когда в них, наряду с формулами веществ, участвующих в реакции, указываются и тепловые эффекты процесса. Термохимические расчеты основаны на двух законах тер - Мохимии, вытекающих из закона сохранения энергии. Изменение энтальпии газов при высоких температурах.| Схема отсчета значений энтальпий от О К и от стандартных условий ( 298, 15 К. Термохимические расчеты с использованием табличных данных значительно упростились. Схема процессов. Термохимические расчеты основаны на законе Гесса и следствии из него. Термохимические расчеты основаны на двух законах тер - Мохимии, вытекающих из закона сохранения энергии. Изменение энтальпии газов при высоких температурах.| Схема отсчета значений энтальпий от О К и от стандартных условий ( 298 15 К. Термохимические расчеты в результате использования табличных данных значительно упростились. Термохимические расчеты, основанные на законе Гесса, следует выполнять с помощью термохимических уравнений, представляющих собой стехиометри-ческие уравнения химических реакций, дополненные необходимыми сведениями о состоянии реагирующих и образующихся веществ, а также указанием тепловых эффектов. Стандартные теплоты фазовых переходов некоторых веществ. Термохимические расчеты для реакций в растворах целесообразно проводить не по теплотам образования молекул, а по тепло-там образования ионов. Однако измерить теплоты образования для отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. Термохимические расчеты проводят, используя энтальпии ( теплоты) образования веществ. Под энтальпией образования понимают тепловой эффект реакции образования 1 моль вещества из простых. Термохимические расчеты удобно производить, руководствуясь следующим выводом, вытекающим из закона Гесса: тепловой эффект химической реакции равняется сумме теплот образования получающихся веществ без суммы теплот образования вступающих в реакцию веществ. Стандартные теплоты фазовых переходов некоторых веществ. Термохимические расчеты для реакций в растворах целесообразно проводить не по теплотам образования молекул, а по тепло-там образования ионов. Однако измерить теплоты образования для отдельных ионов невозможно, так как ионам одного знака всегда сопутствуют ионы противоположного знака. Зависимость активности SiO2 от.| Зависимость активностей SiO2 и РЬО от мольной доли SiC2 в бинарном расплаве. Термохимический расчет в этом случае позволяет определить состав печной атмосферы, при котором стекло не будет восстанавливаться. Термохимические расчеты с использованием табличных данных значительно упростились. Термохимические расчеты процесса конверсии с учетом реальных показателей, полученных в эксперименте, выполненные по методике, приведенной в работе f8j, показали, что потери тепла при использовании опытно-промышленного реактора незначительны. Проведенные ориентировочные термохимические расчеты дают указание на то, что в трехкомпонентной системе As - Ge - Se с большой областью стеклообразования может быть несколько участков, различающихся по содержанию структурных единиц, а следовательно, и по физико-химическим свойствам. Могут быть участки, где преобладают структуры GeSe4 / 2 или AsSes / 2, и участки, где структура определяется в основном связями селенового типа. При соизмеримом содержании тетраэдрических GeSe4 / 2 и тригональных AsSea / 2 в стекле нарушается валентная координационная периодичность, что должно служить стерической помехой к образованию однородной атом-но-дисперсной смеси структурных узлов GeSe4 / 2 и AsSes / 2 и может повлечь за собой химическую микронеоднородность строения стекла путем коллоидально-дисперсного дифференцирования его по типу структурных узлов. При этом на границах раздела микрофаз ( AsSes / 2) m и ( GeSe4 / 2) n, вследствие пространственной несогласованности периодов валентных связей, некоторая часть валентных электронов должна оставаться неспаренной, и создаются тупики и ловушки для носителей тока, ограничивающие сквозную проводимость. Согласно термохимическим расчетам ( см. табл. 39) для 1 3-диолефинов строения - СН2СН eeCHCHCHCH2 - реакции замещения и присоединения равновероятны. Многие термохимические расчеты очень упрощаются, если производить их, пользуясь следующим положением, вьггекающим из закона Гесса. Все термохимические расчеты основаны на двух законах термохимии. Основой термохимических расчетов служит закон Г. И. Гесса: тепловой эффект химической реакции не зависит от ее отдельных стадий, а зависит только от состояния исходных веществ и продуктов реакции. Для термохимических расчетов необходимо, чтобы все теплоты реакций были отнесены к одинаковым условиям. Иначе их значения будут не сопоставимы. Это обстоятельство обусловлено тем, что теплота химической реакции зависит от температуры и в меньшей степени от давления. Обычно теплоты химических реакций приводят к стандартным условиям. Для индивидуальных твердых веществ и жидкостей в качестве стандартного принимают состояние их при 1 атм и данной температуре. Для индивидуальных газов в качестве стандартного принимают их состояние в виде гипотетического идеального газа, летучесть которого равна единице при данной температуре. Свойства индивидуальных газов при 1 атм не слишком отличаются от свойств их в стандартных условиях; в расчетах, не требующих высокой точности, этим различием обычно пренебрегают. Следует обращать внимание на то, что для газовой химической реакции, проводимой в стандартных условиях, не общее давление равно 1 атм, а парциальное давление каждого из газообразных компонентов реакции. Для термохимических расчетов необходимо все теплоты относить к одинаковым условиям - изобарным или изохорным. Для термохимических расчетов важна энтальпия образования соединений. Энтальпией образования вещества называют энтальпию процесса образования этого вещества из простых веществ при данной температуре. К понятию стандартный тепловой эффект. Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям. В противном случае их значения будут не сопоставимы и алгебраическое суммирование станет невозможным. Для термохимических расчетов в производстве серной кислоты необходимо иметь данные о теплоте образования серной кислоты, теплоте разбавления и смешивания кислот, теплоемкости, теплоте испарения воды, теплопроводности, вязкости и др. Объем учебника не позволяет подробно остановиться на этих свойствах серной кислоты, поэтому ниже приводятся только самые общие сведения. Для термохимических расчетов в металлургии, особенно для вычисления констант равновесия, требуется знание термодинамических величин и давления насыщенного пара веществ, участвующих в реакции. Для термохимических расчетов важна энтальпия образования соединений. Энтальпией образования вещества называют энтальпию процесса образования этого вещества из простых веществ при данной температуре. Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям. В противном случае их значения будут несопоставимы и алгебраическое суммирование станет невозможным. Для термохимических расчетов необходимо, чтобы все тепловые эффекты были отнесены к одинаковым условиям. Считается, что газы идеальные. Основой термохимических расчетов служит закон Г. И. Гесса: тепловой эффект химической реакции не зависит от ее отдельных стадий, а зависит только от состояния исходных веществ и продуктов реакции. Для термохимических расчетов часто пользуются законом Гесса, выраженным в такой форме: тепловой эффект реакции равен разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ. Для термохимических расчетов необходимо, чтобы все теплоты реакций были отнесены к одинаковым условиям. Иначе их значения будут не сопоставимы. Это обстоятельство обусловлено тем, что теплота химической реакции зависит от температуры и в меньшей степени от давления. Обычно теплоты химических реакций приводят к стандартным условиям. Для индивидуальных твердых веществ и жидкостей в качестве стандартного принимают состояние их при 1 атм и данной температуре. Для индивидуальных газов в качестве стандартного принимают их состояние в виде гипотетического идеального газа, летучесть которого равна единице при данной температуре. Свойства индивидуальных газов при 1 атм не слишком отличаются от свойств их в стандартных условиях; в расчетах, не требующих высокой точности, этим различием обычно пренебрегают. Следует обращать внимание на то, что для газовой химической реакции, проводимой в стандартных условиях, не общее давление равно 1 атм, а парциальное давление каждого из газообразных компонентов реакции. Для термохимических расчетов необходимо все теплоты относить к одинаковым условиям - изобарным или изохорным. Для термохимических расчетов рабочего процесса жидкостного ракетного двигателя существенное значение имеет состав топлива, и особенно состав продуктов сгорания. В термохимических расчетах часто используют понятия теплота образования и теплота сгорания вещества. Теплоты образования простых веществ при стандартных условиях принимаются равными нулю. Стандартные теплоты сгорания некоторых органических соединений. При термохимических расчетах закон Гесса позволяет оперировать термохимическими уравнениями так же, как обычными алгебраическими уравнениями. В термохимических расчетах широко используют энтальпии ( теплоты) образования веществ. Под энтальпией образования понимают тепловой эффект реакции образования 1 моль вещества из простых веществ. В термохимических расчетах часто пользуются следствиями, которые непосредственно вытекают из закона Гесса. Схема, иллюстри - [ IMAGE ] Схема, иллюстри. При термохимических расчетах особое значение имеют два вида тепловых эффектов химических реакций: теплота образования соединений и теплота сгорания. В термохимических расчетах используется понятие теплоты образования. Теплота образования представляет собой теплоту химической реакции при образовании данного вещества ( какого-то компонента смеси) из исходных простых веществ. Для значительного количества компонентов реакция образования из простых веще % ств на практике не может быть осуществлена и теплоту образования рассматривают в общем случае как вспомогательную величину, играющую важную роль при расчетах теплот химических реакций. Теплоты образования большого количества химических веществ приводятся в справочниках. При термохимическом расчете предполагается, что каждая из нитрогрупп фрагмента C ( NO2) 3 влияет на углеводородную часть молекулы так же, как нитрогруппа в мо-нонитросоединениях.
Билет 7.
Энтропия - понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии.
Понятие энтропии впервые было введено Клаузиусом в термодинамике в 1865 году для определения меры необратимого рассеивания энергии, меры отклонения реального процесса от идеального. Определённая как сумма приведённых теплот, она является функцией состояния и остаётся постоянной при обратимых процессах, тогда как в необратимых — её изменение всегда положительно.
![]()
где![]() — приращение энтропии;
— приращение энтропии;
![]() — минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса.
— минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса.
Стандартная энтропия S0 - энтропия при давлении р=1,01·105 Па (1 атм)
Энтропия Гиббса.
В термодинамика, особенно в статистической механике, формула энтропии Гиббса
![]()
служит стандартной формулой для вычисления статистической механической энтропии термодинамической системы; суммирование ведётся по всем возможным состояниям системы (обычно по 6N-мерным точкам, если система состоит из N частиц); множитель kB отражает два факта:
-выбор основания логарифма
-выбор температурной шкалы.
S почти повсеместно называют просто энтропией; ёё можно также назвать статистической энтропией или термодинамической энтропией без изменения смысла.
Стандартное изменение энергии Гиббса и его расчет.
Энтропийный метод расчёта ΔG реакции является одним из самых распространённых и удобных. Он основан на соотношении:
![]()
или, соответственно, для стандартного изменения энергии Гиббса
![]()
Здесь ΔH0 при постоянных давлении и температуре равно тепловому эффекту реакции, методы расчёта и экспериментального определения которого известны — см., например, уравнение Кирхгофа:
![]()
Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
По термическим данным — с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
![]()
где S0 = 0 (постулат Планка) и тогда, соответственно,
![]()
(здесь индекс sol — от англ. solid). При некоторой заданной температуре T:
![]()
Для жидких или газообразных при нормальной температуре веществ, или, в более общем случае, для веществ, в интервале температур от 0 (или 298) и до T претерпевающих фазовый переход, следует учитывать изменение энтропии, связанное с этим фазовым переходом.
Для идеальных газов — методами квантовой статистики.
Различными эмпирическими и полуэмпирическими методами, для этого часто достаточно небольшого объёма исходных данных. Например, для твёрдых неорганических веществ оценить энтропию можно по формуле:
![]()
где A и B — табличные константы, зависящие от типа рассматриваемого соединения, M — молекулярная масса.
Итак,
если извеcтны
![]() ,
,
![]() и температурные зависимости теплоёмкости,
и температурные зависимости теплоёмкости,
![]() может быть рассчитано по формуле:
может быть рассчитано по формуле:
![]()
Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
![]()
И еще более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
![]()
Переход от к константе равновесия осуществляется по приведённой выше формуле.
Самопроизвольное протекание реакции зависит от температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняются закономерности, которая была высказана в общем виде в 1885 году французским ученым Ле-Шателье.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.[1]
А2 + В2 ⇄ 2AB
билет № 8
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице реакционного пространства.
Если концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за промежуток времени от t1 до t2, то в соответствии с определением скорость реакции равна (рис. 1):
![]()
Знак «–» в правой части уравнения означает следующее. По мере протекания реакции (t2 – t1) > 0 концентрация реагентов убывает, следовательно, (c2 – c1) < 0, а т.к. скорость реакции всегда положительна, то перед дробью следует поставить знак «–».
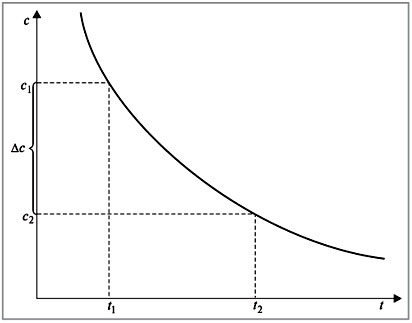
Рис. 1.
Изменение концентрации исходного вещества
в зависимости от времени. Кинетическая кривая
Kоличественно зависимость между скоростью реакции и молярными концентрациями реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ.Для реакции
аА + bВ = сС + dD,
в соответствии с законом действующих масс, зависимость скорости от концентраций реагирующих веществ может быть представлена в виде:
![]() где
k
– константа скорости; nА,
nB
– порядки реакции соответственно по
реагентам А и В; nА
+ nB
– общий порядок реакции.
где
k
– константа скорости; nА,
nB
– порядки реакции соответственно по
реагентам А и В; nА
+ nB
– общий порядок реакции.
Далее раскрываются понятия о гомо- и гетерогенных реакциях и их особенностях.
В г о м о г е н н ы х р е а к ц и я х реагирующие вещества находятся в одной газовой фазе или в растворе, равномерно перемешаны между собой, реакция идет по всему объему смеси. Kонцентрация реагента равна частному от деления количества вещества на объем смеси: с = /V.
Средняя
скорость реакции:
![]()
Чем меньше промежуток времени, тем более точным будет значение скорости реакции
Г е т е р о г е н н ы е р е а к ц и и идут на границе раздела фаз: газ – твердое вещество, газ – жидкость, жидкость – твердое вещество, твердое вещество – твердое вещество.
Скорость
реакции![]() измеряется
на единице площади соприкосновения
реагирующих веществ S.
измеряется
на единице площади соприкосновения
реагирующих веществ S.
При рассмотрении тепловых эффектов химических реакций превращение молекул реагентов (А + В) в молекулы продуктов (С + D) c термодинамической точки зрения объясняется как «восхождение на энергетическую гору» в случае эндотермических реакций (рис. 2, а) или «спуск с горы» для экзотермических реакций (рис. 2, б).
Молекулам реагентов, чтобы прореагировать, необходимо предварительно запастись дополнительной энергией, чтобы преодолеть энергетический барьер на пути к продуктам реакции. Существенно, что такой барьер имеется и в случае экзотермических реакций, так что вместо простого «соскальзывания с горки» молекулам приходится предварительно «лезть в гору».
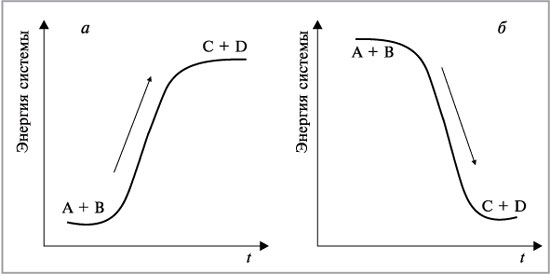
Рис. 2.
Зависимости энергии от времени: а – эндотермическая реакция: А + В С + D – Q; б – экзотермическая реакция: А + В С + D + Q
Движущая сила реакции – стремление прийти к минимуму энергии.

Для того чтобы реакция могла протекать, частицы реагирующих веществ должны столкнуться друг с другом. С ростом температуры число этих столкновений возрастает вследствие увеличения кинетической энергии молекул, поэтому увеличивается скорость реакции. Но далеко не всякое соударение молекул реагирующих веществ приводит к их взаимодействию: для взаимодействия молекул связи между атомами в них должны стать слабее или порваться, на что должна быть затрачена определенная энергия. Если сталкивающиеся молекулы не обладают такой энергией, их столкновение не приводит к реакции. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию молекул нового вещества, называется энергией активации данной реакции Еа, обычно измеряется в Дж/моль, кДж/моль. Молекулы, обладающие такой энергией, называются активными молекулами.
На рис. 3 изображены энергетические профили:
а)
эндотермической реакции, +![]() H
= –Q,
N2
+ O2
H
= –Q,
N2
+ O2![]() 2NO
– Q;
2NO
– Q;
б) экзотермической реакции, – H = +Q, H2 + I2 2HI + Q.
В
процессе реакции химические связи в
активных молекулах ослабевают и возникают
новые связи между частицами реагирующих
веществ, образуется переходное состояние
– активированный комплекс, когда старые
связи не полностью разрушены, а новые
уже начали строиться. Энергия активации
– энергия, необходимая для возникновения
активированного комплекса. Энергетический
барьер различен, чем он ниже, тем легче
и быстрее идет реакц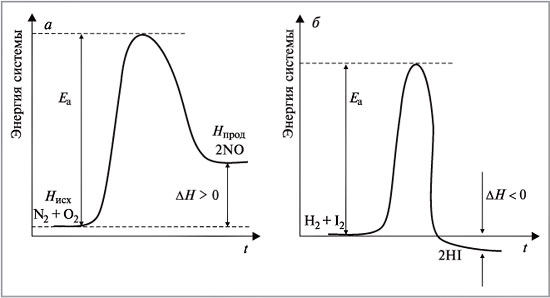
Энергетические профили эндо- и экзотермической реакций на примере образования оксида азота(II) NO (а) и йодоводорода HI (б)
Точка,
находящаяся на вершине энергетического
барьера, носит название переходного
состояния. Из этой точки система может
свободно перейти в продукт реакции либо
вернуться в исходное состояние (рис.
4).
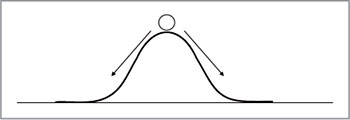
Рис. 4.
Физическая модель процесса –
шар на вершине горки
Энергия активации – это фактор, посредством которого природа реагирующих веществ влияет на скорость реакции. Для некоторых реакций она мала, для других – велика. Если энергия активации мала (< 40 кДж/моль), то большая часть столкновений между молекулами реагирующих веществ приводит к реакции. Скорость таких реакций велика. Если энергия активации велика (> 40 кДж/моль), то в этом случае лишь малая часть столкновений молекул или других частиц приводит к реакции. Скорость подобной реакции мала.
Скорость реакции в данный момент времени можно рассчитать, если знать число активных соударений реагирующих частиц в единицу времени. Поэтому зависимость скорости реакции от температуры можно записать в виде:
= 0exp(–Ea/RT),
где 0 – скорость реакции при условии, что каждое соударение приводит к взаимодействию (Еа = 0). Это выражение для скорости реакции – уравнение Аррениуса – важное уравнение в химической кинетике (его практическое применение см. в приложении № 2, учащиеся делают сообщения).
Почему химические реакции идут с разной скоростью? Вот основной вопрос, который стоит перед учителем и ребятами на уроке. Учащиеся отвечают на него теоретически, проводя лабораторные эксперименты в группах и решая задачи.
Правило Вант - Гоффа и уравнение Аррениуса.
ВАНТ-ГОФФА ПРАВИЛО. Почти все химические реакции при повышении температуры идут быстрее. Зависимость скорости реакции от температуры описывается уравнением Аррениуса: k = Ae–Ea/RT, где k – константа скорости реакции, А – не зависящая от температуры константа (ее называют предэкспоненциальным множителем), Еа – энергия активации, R – газовая постоянная, Т – абсолютная температура. Однако из уравнения Аррениуса следует, что температурный коэффициент реакции зависит как от энергии активации, так и от абсолютной температуры. Для данной реакции с определенным значением Еа ускорение при повышении температуры на 10° будет тем больше, чем ниже температура. Это почти очевидно и без расчетов: повышение температуры от 0 до 10° С должно сказаться на скорости реакции значительно сильнее, чем такое же повышение температуры, например, от 500 до 510° С. С другой стороны, для данного температурного интервала ускорение реакции будет тем сильнее, чем больше ее энергия активации. Для реакций же с большой энергией активации, которые при невысоких температурах идут медленно, ускорение при повышении температуры на 10° С может значительно превысить 4-кратное.
Энергия активации
разность между значениями средней энергии частиц (молекул, радикалов, ионов и др.), вступающих в элементарный акт химической реакции, и средней энергии всех частиц, находящихся в реагирующей системе. Для различных химических реакций Э. а. изменяется в широких пределах — от нескольких до Энергия активации 10 дж./ моль. Для одной и той же химической реакции значение Э. а. зависит от вида функций распределения молекул по энергиям их поступательного движения и внутренним степеням свободы (электронным, колебательным, вращательным). Как статистическую величину Э. а. следует отличать от пороговой энергии, или энергетического барьера, — минимальной энергии, которой должна обладать одна пара сталкивающихся частиц для протекания данной элементарной реакции.
В рамках представлений теории абсолютных скоростей реакций Э. а. — разность между значениями средней энергии активированных комплексов и средней энергии исходных молекул. k = koe-E/RT где R — Газовая постоянная, Т — абсолютная температура в К, ko — постоянная, называемая предэкспоненциальным множителем константы скорости. Э. а. можно найти по экспериментальным данным несколькими способами. Согласно одному из них, исследуют кинетику реакции при нескольких температурах и строят график в координатах In k — 1/T; тангенс угла наклона прямой на этом графике, в соответствии с уравнением Аррениуса, равен Е. Э. а. сложных реакций представляет собой комбинацию Э. а. элементарных стадий. Иногда, помимо истинной Э. а., определяемой по уравнению Аррениуса, используют понятие «кажущейся» Э. а.
1. Катализаторы в химии
- Виды Катализаторов
- Механизм действия Катализаторов
- Требования, предъявляемые к Катализаторам
2. Катализаторы в автомобилях
- Каталитический преобразователь
- Выбросы загрязняющих веществ
- Как Катализаторы сокращают вредные выбросы в выхлопных газах
- Контроль загрязнения и повышение эффективности выхлопной системы
- Экономия топлива и Катализаторы горения
Катализатор — это вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции. Количество Катализатора, в отличие от других реагентов, после реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на товар и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (до миллиона раз) повторяется. Катализаторы - это вещества, изменяющие скорость химической реакцции или вызывающие ее, но не входящие в состав продуктов.
Катализаторы в химии
Виды Катализаторов Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными Катализаторами являются кислоты и основания. В качестве гетерогенных Катализаторов применяются металлы, их оксиды и сульфиды.
Механизм действия Катализаторов Механизм действия Катализаторов обычно объясняют образованием промежуточных соединений с одним из реагирующих веществ. Так, если медленно протекающую реакцию А + В = АВ вести в присутствии Катализатора К, то катализатор вступает в химическое взаимодействие с одним из исходных веществ, образуя непрочное промежуточное соединение:
А + К = АК
Реакция протекает быстро, так как энергия активации этого процесса мала. Затем промежуточное соединение АК взаимодействует с другим исходным веществом, при этом катализатор высвобождается:
АК + В = АВ + К
Энергия активации этого процесса также мала, а потому реакция протекает с достаточной скоростью. Если теперь оба процесса, протекающие одновременно, суммировать, то получим окончательное уравнение быстро протекающей реакции:
А + В = АВ
Приведем конкретный пример - окисление SО2 в SО3 с участием Катализатора NO:
SO2 + ½O2 = SO3
A + B = AB
Эта реакция протекает медленно. Но при введении Катализатора образуется промежуточное соединение:
NO + ½ O2 = NO2
K + B = KB
и далее
SO2 + NO2 = SO3 + NO
А + КВ = АВ + К
