
- •2.Вопрос.(хз может не полный ) Стехиометрические расчеты по уравнениям реакций.
- •3.Вопрос
- •4.Вопрос
- •5.Вопрос.
- •Билет №6
- •Следствия из закона Гесса
- •Билет 9 Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •5.1.3. Принцип Ле Шателье
- •5.2. Химическое равновесие в гетерогенных системах
- •Растворимость
- •Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •1. Теория электрической диссоциации Аррениуса.
- •2. Сильные и слабые электролиты
- •3. Константа диссоциации слабых электролитов
- •4. Закон разбавления Освальда
- •Билет 12
- •1.Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении. Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Сильные электролиты
- •Вывод значения pH
- •Значения pH в растворах различной кислотности
- •5. Различные случаи гидролиза.
- •6. Степень гидролиза и зависимость ее от концентрации и температуры.
- •7.Смещение равновесия гидролиза.
- •13 Билет.
- •По составу
- •По назначению
- •Паста коки
- •Влияние пав на компоненты окружающей среды
- •17 Билет.
- •Химические источники тока.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •3.Концентрационные цепи
- •По значению э. Д. С. Гальванического элемента
- •4.Гальванические элементы с газовыми электродами
- •5. Окислительно-восстановительные
- •6.Аккумуляторы
- •7.Топливные элементы
- •Билет 19 Электролиз как окислительно-восстановительный процесс
- •Популярные места применения керамики
17 Билет.
Окислительно-Восстановительная реакция – это химические реакции, которые протекают с изменением степени окисления атомов в молекулах реагирующих веществ.
Степень окисления элементов изменяются, потому что при протекании ОВР происходит переход электрона от атомов одного элемента к атомам другого элемента, то есть один атом отдает электроны, а другой атом присоединяет.
Процесс отдачи электрона называется окислением.
При окислении степень окисления элемента повышается. Процесс присоединения электронов называется восстановлением. При восстановлении степень окисления понижается.
Окисление всегда сопровождается восстановлением, а восстановление окислением, поэтому ОВР представляет собой единство двух противоположных процессов – окисление и восстановление.
Атомы, молекулы или ионы которые отдают электроны в процессе окисления – восстановители. Восстановители в процессе реакции окисляются.
Атомы, молекулы или ионы которые отдают электроны в процессе восстановления – окислители.
Окислители в процессе реакции восстанавливаются.
1 группа – вещества, которые могут быть только окислителями (находятся в высшей степени окисления).
2 группа – вещества, которые могут быть восстановителями (в низшей степени окисления).
3 группа – вещества, которые могут быть и окислителями и восстановителями (с промежуточными степенями окисления).
Типы ОВР:
Межмолекулярные реакции – это реакции которые идут с изменением степени окисления атомов в различных молекулах.
Внутримолекулярные реакции – это реакции в которых атомы изменяющие свои степени окисления находятся в одной молекуле.
Реакции диспропорционирования (самоокисление – самовосстановление) – это реакции которые идут с изменением степени окисления атомов одного и того же элемента.
При переходе некоторого количества металла из решетки в раствор освобождается эквивалентное количество электронов. Поскольку электроны не способны гидратироваться, они остаются в металле, сообщая ему отрицательный заряд. Раствор вблизи поверхности металла в свою очередь обогатился избыточным количеством положительных зарядов, перешедших из металла в раствор вместе с катионами. Таким образом, на границе металл—электролит появляется двойной электрический слой, в котором металл оказывается отрицательно заряженным, а электролит — положительно заряженным. Возникает скачок потенциала.
Электрические потенциалы на фазовых границах При соприкосновении проводника первого рода (электрода) с полярным растворителем (водой) либо раствором электролита на границе электрод – жидкость возникает т.н. двойной электрический слой (ДЭС). В качестве примера рассмотрим медный электрод, погруженный в воду либо в раствор сульфата меди. При погружении медного электрода в воду часть ионов меди, находящихся в узлах кристаллической решетки, в результате взаимодействия с диполями воды будет переходить в раствор. Возникающий при этом на электроде отрицательный заряд будет удерживать перешедшие в раствор ионы в приэлектродном пространстве – образуется двойной электрический слой.
В гальваническом элементе химическая энергия преобразуется в электрическую. Простейший гальванический элемент представляет собой два сосуда с растворами CuSO4 и ZnSO4, в которые погружены соответственно медная и цинковая пластинки. Сосуды соединены между собой трубкой, которая называется солевым мостиком, заполненной раствором электролита (например, KCl). Такая система называется медно-цинковым гальваническим элементом. На аноде протекает процесс окисления цинка:
Zn – 2е– = Zn2+.
В результате этого атомы цинка превращаются в ионы, которые переходят в раствор, а цинковый анод растворяется, и его масса уменьшается. Суммарное уравнение реакции, протекающей в медно-цинковом гальваническом элементе, можно представить так:
Zn + Cu2+ = Zn2+ + Cu.
Электродвижущая сила (ЭДС) — скалярная физическая величина, характеризующая работу сторонних (непотенциальных) сил в источниках постоянного или переменного тока. В замкнутом проводящем контуре ЭДС равна работе этих сил по перемещению единичного положительного заряда вдоль контура.
ЭДС
можно выразить через напряжённость
электрического поля сторонних сил
(![]() ).
В замкнутом контуре (
).
В замкнутом контуре (![]() )
тогда ЭДС будет равна:
)
тогда ЭДС будет равна:
![]() ,
где
,
где
![]() —
элемент длины контура.
—
элемент длины контура.
Стандартный водоро́дный электро́д — электрод, использующийся в качестве электрода сравнения при различных электрохимических измерениях и в гальванических элементах. Водородный электрод (ВЭ) представляет собой пластинку или проволоку из металла, хорошо поглощающего газообразный водород (обычно используют платину или палладий), насыщенную водородом (при атмосферном давлении) и погруженную в водный раствор, содержащий ионы водорода. Потенциал пластины зависит[уточнить] от концентрации ионов Н+ в растворе. Электрод является эталоном, относительно которого ведется отсчет электродного потенциала определяемой химической реакции. При давлении водорода 1 атм., концентрации протонов в растворе 1 моль/л и температуре 298 К потенциал ВЭ принимают равным 0 В. При сборке гальванического элемента из ВЭ и определяемого электрода, на поверхности платины обратимо протекает реакция:
2Н+ + 2e− = H2
то есть, происходит либо восстановление водорода, либо его окисление — это зависит от потенциала реакции, протекающей на определяемом электроде
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au |
Ряд напряжений характеризует сравнительную активность металлов в окислительно-восстановительные реакциях в водных растворах.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
![]() ,
,
где
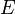 —
электродный
потенциал,
—
электродный
потенциал,
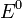 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;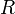 —
универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);
—
универсальная
газовая постоянная, равная 8.31
Дж/(моль·K);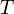 —
абсолютная
температура;
—
абсолютная
температура; —
постоянная
Фарадея, равная 96485,35 Кл·моль−1;
—
постоянная
Фарадея, равная 96485,35 Кл·моль−1;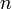 —
число
моль
электронов,
участвующих в процессе;
—
число
моль
электронов,
участвующих в процессе;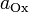 и
и
 —
активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
—
активности
соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант
и
и
перейти от натуральных
логарифмов к десятичным,
то при
![]() получим
получим
![]()
Билет 18
