
- •2.Вопрос.(хз может не полный ) Стехиометрические расчеты по уравнениям реакций.
- •3.Вопрос
- •4.Вопрос
- •5.Вопрос.
- •Билет №6
- •Следствия из закона Гесса
- •Билет 9 Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •5.1.3. Принцип Ле Шателье
- •5.2. Химическое равновесие в гетерогенных системах
- •Растворимость
- •Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •1. Теория электрической диссоциации Аррениуса.
- •2. Сильные и слабые электролиты
- •3. Константа диссоциации слабых электролитов
- •4. Закон разбавления Освальда
- •Билет 12
- •1.Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении. Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Сильные электролиты
- •Вывод значения pH
- •Значения pH в растворах различной кислотности
- •5. Различные случаи гидролиза.
- •6. Степень гидролиза и зависимость ее от концентрации и температуры.
- •7.Смещение равновесия гидролиза.
- •13 Билет.
- •По составу
- •По назначению
- •Паста коки
- •Влияние пав на компоненты окружающей среды
- •17 Билет.
- •Химические источники тока.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •3.Концентрационные цепи
- •По значению э. Д. С. Гальванического элемента
- •4.Гальванические элементы с газовыми электродами
- •5. Окислительно-восстановительные
- •6.Аккумуляторы
- •7.Топливные элементы
- •Билет 19 Электролиз как окислительно-восстановительный процесс
- •Популярные места применения керамики
Паста коки
Дешёвый продукт, получаемый первичной экстракцией кокаина из листьев коки. Беловатый, кремовый или бежевый порошок, обычно влажный, содержащий мягкие, легко разрушаемые надавливанием пальца агрегаты. Помимо кокаина содержит вещества, добавляемые для экстракции, например, карбонат марганца. Содержание кокаина колеблется от 40 до 90 %.
Пове́рхностно-акти́вные вещества́ (ПАВ) — химические соединения, которые, концентрируясь на поверхности раздела фаз, вызывают снижение поверхностного натяжения.
Основной количественной характеристикой ПАВ является поверхностная активность — способность вещества снижать поверхностное натяжение на границе раздела фаз — это производная поверхностного натяжения по концентрации ПАВ при стремлении С к нулю. Однако, ПАВ имеет предел растворимости (так называемую критическую концентрацию мицеллообразования или ККМ), с достижением которого при добавлении ПАВ в раствор концентрация на границе раздела фаз остается постоянной, но в то же время происходит самоорганизация молекул ПАВ в объёмном растворе (мицеллообразование или агрегация). В результате такой агрегации образуются так называемые мицеллы. Отличительным признаком мицеллообразования служит помутнение раствора ПАВ. Водные растворы ПАВ, при мицеллообразовании также приобретают голубоватый оттенок (студенистый оттенок) за счёт преломления света мицеллами.
Методы определения ККМ:
Метод поверхностного натяжения
Метод измерения контактного угла с тв. или жидкой поверхностью (Contact angle)
Метод вращающейся капли (Spindrop/Spinning drop)
Как правило, ПАВ — органические соединения, имеющие амфифильное строение, то есть их молекулы имеют в своём составе полярную часть, гидрофильный компонент(функциональные группы -ОН, -СООН, -SOOOH, -O- и т. п., или, чаще, их соли -ОNa, -СООNa, -SOOONa и т. п.) и неполярную (углеводородную) часть, гидрофобный компонент. Примером ПАВ могут служить обычное мыло (смесь натриевых солей жирных карбоновых кислот — олеата, стеарата натрия и т. п.) и СМС (синтетические моющие средства), а также спирты, карбоновые кислоты, амины и т. п.
Классификация ПАВ
Ионогенные ПАВ
Катионные ПАВ
Анионные ПАВ
Амфотерные
Неионогенные ПАВ
Алкилполиглюкозиды
Алкилполиэтоксилаты
Влияние пав на компоненты окружающей среды
ПАВ делятся на те, которые быстро разрушаются в окружающей среде и те, которые не разрушаются и могут накапливаться в организмах в недопустимых концентрациях. Один из основных негативных эффектов ПАВ в окружающей среде — понижение поверхностного натяжения. Например, в океане изменение поверхностного натяжения приводит к снижению показателя удерживания CO2 и кислорода в массе воды. Только немногие ПАВ считаются безопасными (алкилполиглюкозиды), так как продуктами их деградации являются углеводы. Однако при адсорбировании ПАВ на поверхности частичек земли/песка степень/скорость их деградации снижаются многократно. Так как почти все ПАВ, используемых в промышленности и домашнем хозяйстве, имеют положительную адсорбцию на частичках земли, песка, глины, при нормальных условиях они могут высвобождать (десорбировать) ионы тяжёлых металлов, удерживаемые этими частичками, и тем самым повышать риск попадания данных веществ в организм человека.
Области применения
Моющие средства. Основное применение ПАВ — в качестве активного компонента моющих и чистящих средств (в том числе, применяемых для дезактивации),мыла, для ухода за помещениями, посудой, одеждой, вещами, автомобилями и пр. В 2007 году в России было произведено более 1 млн тонн синтетических моющих средств, главным образом — стиральных порошков.
Косметика. Основное использование ПАВ в косметике — шампуни, где содержание ПАВ может достигать десятков процентов от общего объёма. Также ПАВ используются в небольших количествах в зубной пасте, лосьонах, тониках и других продуктах.
Текстильная промышленность. ПАВ используются в основном для снятия статического электричества на волокнах синтетической ткани.
Кожевенная промышленность. Защита кожаных изделий от лёгких повреждений и слипания.
Лакокрасочная промышленность. ПАВ используются для снижения поверхностного натяжения, что обеспечивает лёгкое проникновение красочного материала в маленькие углубления на обрабатываемой поверхности и их заполнение с вытеснением при этом оттуда другого вещества (например, воды).
Бумажная промышленность. ПАВ используются для разделения чернил и варёной целлюлозы при переработке использованной бумаги. Молекулы ПАВ адсорбируются на пигменте чернил. Пигмент становится гидрофобным. Далее воздух пропускается через раствор пигмента и целлюлозы. Пузырьки воздуха адсорбируются на гидрофобной части ПАВ и частички пигмента чернил всплывают на поверхность.
Металлургия. Эмульсии ПАВ используются для смазки прокатных станов. Снижают трение. Выдерживают высокие температуры, при которых сгорает масло.
Защита растений. ПАВ широко используются в агрономии и сельском хозяйстве для образования эмульсий. Используются для повышения эффективности транспортировки питательных компонентов к растениям через мембранные стенки.
Пищевая промышленность. ПАВ в виде эмульгаторов (например, лецитина) добавляют для улучшения вкусовых качеств мороженого, шоколада, взбитых сливок, соусов для салатов и других блюд.
Нефтедобыча. ПАВ применяются для гидрофобизации призабойной зоны пласта (ПЗП) с целью увеличения нефтеотдачи.
Строительство. ПАВ, называемые пластификаторами, добавляют к цементно-песчаным смесям и бетонам для уменьшения их водопотребности при сохранении подвижности. Это увеличивает конечную прочность (марку) затвердевшего материала, его плотность, морозостойкость, водонепроницаемость.
Медицина. Катионные и анионные ПАВ применяют в хирургии в качестве антисептиков. Например, четвертичные аммониевые соединения приблизительно в 300 раз эффективнее фенола по губительному действию в отношении микроорганизмов.
Билет 16
16. Химические свойства металлов: взаимодействия металлов с простыми окислителями, отношение к воде, водным растворам кислот, щелочей и солей. Взаимодействие металлов с азотной и концентрированной серной кислотами, смесями кислот.
Химические свойства металлов- Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов, обладающая характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность и металлический блеск.
Взаимодействия металлов с простыми окислителями - Металлы чаще всего реагируют со следующими окислителями - простыми веществами: кислородом, галогенами, серой, азотом, водородом. По окислительной активности кислоты условно делят на 2 группы:
1) кислоты - слабые окислители (HF, HCl, HBr, HI, H2S, H2CO3, H3PO4, H2SO3, CH3COOH и др.). В растворах этих кислот окислителем является ион водорода (H+).
2) кислоты - сильные окислители (HNO3, H2SO4, H2SeO4, HClO4, HMnO4 и др. Окислителями в растворах этих кислот являются кислородсодержащие анионы HSO4-, SO42-, NO3-, ClO4- и т.д.
ОТНОШЕНИЕ МЕТАЛЛОВ К ВОДЕ- В реакциях данного типа роль окислителя играют ионы водорода, образующиеся при диссоциации молекул воды. При рН = 7 j°2H+/H2 = -0,41 В, следовательно, с водой теоретически могут реагировать все металлы, имеющие величину j° меньше -0,41 В. Реально же наблюдается следующее:
а) активные металлы интенсивно взаимодействуют с водой, вытесняя при этом водород:
2K + 2H2O = 2KOH + H2
Аналогичная реакция с Mg протекает при нагревании:
Mg + 2H2O Mg(OH)2 + H2 ,
водным растворам кислот- а). Отношение металлов к концентрированной H2SO4 .
Окислителем
в концентрированных растворах
H2SO4 является
S в ионах HSO4-,
SO42-.
В зависимости от активности металла он
может восстанавливаться до H2S
(),
S или до SO2(см.
схему).
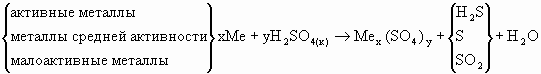
Отношение металлов к разбавленной HNO3.
Кроме этих соединений, во всех трех случаях основными продуктами реакции также являются соответствующая соль (сульфат или гидросульфат) и вода:
4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
Pb + 3H2SO4(к) = H2[Pb(SO4)2] + SO2 + 2H2O
С водными растворами щелочей- взаимодействуют металлы, расположенные в ряду напряжений до водорода и образующие амфотерные гидроксиды: Be, Al, Zn, Cr, Sn, Pb. Взаимодействие часто обусловлено сдвигом величины электродного потенциала металла в сторону отрицательных значений за счет процесса образования гидроксокомплексов. В качестве примера рассмотрим реакцию:
Zn + 2H2O + 2NaOH = Na2[Zn(OH)4] + H2 ,
где j ок.(иона H+) = -0,828 В (pH = 14) меньше, чем j восст.(Zn) = -0,763 В. Тем не менее, данный процесс возможен.
Взаимодействие металлов с концентрированной H2SO4-
а). Отношение металлов к концентрированной H2SO4 .
Окислителем в концентрированных растворах H2SO4 является S в ионах HSO4-, SO42-. В зависимости от активности металла он может восстанавливаться до H2S (), S или до SO2(см. схему).
Кроме этих соединений, во всех трех случаях основными продуктами реакции также являются соответствующая соль (сульфат или гидросульфат) и вода:
4Mg + 5H2SO4(к) = 4MgSO4 + H2S + 4H2O
3Zn + 4H2SO4(к) = 3ZnSO4 + S + 4H2O
Cu + 2H2SO4(к) = CuSO4 + SO2 + 2H2O
Pb + 3H2SO4(к) = H2[Pb(SO4)2] + SO2 + 2H2O
или Pb(HSO4)2
Некоторые металлы взаимодействуют с концентрированными и разбавленными растворами H2SO4 неодинаково. Так, олово с разбавленной H2SO4 образует соль катионного типа, повышая свою степень окисления до (+2):
Sn + H2SO4(р) = SnSO4 + H2 ,
а с концентрированной H2SO4 образует соль, в которой олово находится в высшей степени окисления (+4):
Sn + 4H2SO4 = Sn(SO4)2 + 2SO2 + 2H2O
В концентрированных растворах H2SO4 пассивируются на холоду Al, Cr, Fe, Co, Ni, Ti, Zr, Hf, Mo, W и др.
Не взаимодействуют с H2SO4: Pt, Au, Ru, Rh, Ir, и др.
. Отношение металлов к разбавленной HNO3.
Окислителем в растворах HNO3 является нитрат-ион: NO3-. Как и в предыдущем случае, состав основных продуктов реакции определяется активностью металла (см. схему), участвующего во взаимодействии:

ОТНОШЕНИЕ МЕТАЛЛОВ К СМЕСЯМ ОКИСЛИТЕЛЕЙ
Для решения ряда технологических вопросов, связанных с получением или обработкой некоторых металлов, иногда приходится использовать в качестве окислителей различные смеси сложных веществ. В качестве примеров можно привести процессы окисления ряда металлов в щелочной среде:
а) нитратами:
![]()
![]()
![]()
б) гипохлоритами:
![]()
![]()
в) хлоратами:
![]()
г) пероксидами (H2O2, Na2O2 и др.):
![]() Возможно
использование и других окислительных
смесей.
Возможно
использование и других окислительных
смесей.
