
- •2.Вопрос.(хз может не полный ) Стехиометрические расчеты по уравнениям реакций.
- •3.Вопрос
- •4.Вопрос
- •5.Вопрос.
- •Билет №6
- •Следствия из закона Гесса
- •Билет 9 Химическое равновесие в гомогенных системах
- •5.1.1. Константа химического равновесия
- •5.1.2. Влияние температуры на константу равновесия
- •5.1.3. Принцип Ле Шателье
- •5.2. Химическое равновесие в гетерогенных системах
- •Растворимость
- •Способы выражения концентрации растворов
- •Пересчет концентраций растворов из одних единиц в другие
- •Упаривание раствора
- •Концентрирование раствора
- •Смешивание растворов с разными концентрациями
- •Разбавление раствора
- •1. Теория электрической диссоциации Аррениуса.
- •2. Сильные и слабые электролиты
- •3. Константа диссоциации слабых электролитов
- •4. Закон разбавления Освальда
- •Билет 12
- •1.Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении. Диссоциация в растворах
- •Диссоциация при плавлении
- •Классическая теория электролитической диссоциации
- •Сильные электролиты
- •Вывод значения pH
- •Значения pH в растворах различной кислотности
- •5. Различные случаи гидролиза.
- •6. Степень гидролиза и зависимость ее от концентрации и температуры.
- •7.Смещение равновесия гидролиза.
- •13 Билет.
- •По составу
- •По назначению
- •Паста коки
- •Влияние пав на компоненты окружающей среды
- •17 Билет.
- •Химические источники тока.
- •Гальванические элементы
- •Электрические аккумуляторы
- •Топливные элементы
- •3.Концентрационные цепи
- •По значению э. Д. С. Гальванического элемента
- •4.Гальванические элементы с газовыми электродами
- •5. Окислительно-восстановительные
- •6.Аккумуляторы
- •7.Топливные элементы
- •Билет 19 Электролиз как окислительно-восстановительный процесс
- •Популярные места применения керамики
6.Аккумуляторы
Аккумуляторы – это устройства, в которых электрическая энергия внешнего источника тока превращается в химическую энергию и накапливается, а химическая – снова превращается в электрическую. Процесс накопления химической энергии называется зарядом аккумулятора, процесс превращения химической энергии в электрическую – разрядом. При заряде аккумулятор работает как электролизер, при разряде - как гальванический элемент. Процессы заряда – разряда в аккумуляторах осуществляются многократно.
Одним из наиболее распространенных является свинцовый (или кислотный) аккумулятор, в котором электролитом является 25 - 30 % раствор серной кислоты. Электродами кислотного аккумулятора являются свинцовые решетки, первоначально заполненные оксидом свинца, который при взаимодействии с электролитом превращается в PbSO4. Решетки отделяются друг от друга пористыми сепараторами.
Схематическое изображение свинцового кислотного аккумулятора имеет вид
Pb|H2SO4|PbO2|Pb,
а токообразующая реакция описывается уравнением
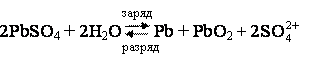 , Eэ = 2.1
В.
, Eэ = 2.1
В.
В результате заряда активная масса одного электрода превращается из PbSO4 в Pb, а активная масса второго электрода из PbSO4 – в PbO2.
Свинцовые аккумуляторы обладают высоким К.П.Д. (до 80 %), высокой Э.Д.С., простотой и малой ценой, что обуславливает их широкое применение на транспортных средствах в качестве стартерных аккумуляторов. Срок службы аккумулятора до 5лет.
Щелочные аккумуляторы обладают большим сроком службы, до 10 лет, и высокой механической прочностью. Наибольшее применение получили никель-кадмиевые и никель-железные аккумуляторы, в которых электролитом служит 20-23 % раствор KOH. Положительным электродом является гидроксид никеля, отрицательным – либо кадмий, либо железо.
Уравнения электродных процессов описываются уравнениями
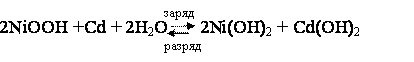 Eэ = 1,45
В.
Eэ = 1,45
В.
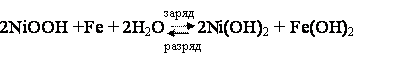 Eэ = 1,48
В.
Eэ = 1,48
В.
Этот тип аккумуляторов обладает меньшими К.П.Д. и напряжением по сравнению с кислотным.
7.Топливные элементы
Топливный элемент— электрохимическое устройство, подобное гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне — в отличие от ограниченного количества энергии, запасенного в гальваническом элементе или аккумуляторе.
В топливном элементе окислитель и восстановитель хранятся вне элемента и в процессе работы непрерывно и раздельно подаются к электродам, где происходит непосредственное превращение химической энергии в электрическую. Электроды топливного элемента в процессе работы не расходуются. Удельная энергия топливного элемента (энергия единичного объема или массы) значительно превышает энергию гальванических элементов. В качестве восстановителя в топливных элементах используют водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии, окислителем, обычно, кислород воздуха или чистый.
В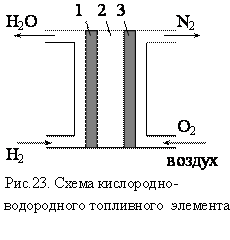 кислородно-водородном топливном элементе
(рис. 23) со щелочным электролитом (2)
происходит превращение химической
энергии в электрическую, в реакции
кислородно-водородном топливном элементе
(рис. 23) со щелочным электролитом (2)
происходит превращение химической
энергии в электрическую, в реакции
Н2 + ½O2 = H2O.
К аноду (1) топливного элемента подводится топливо (восстановитель – H2), к катоду (3) – окислитель (кислород).
Схема элемента имеет вид
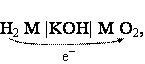
где M – проводник 1-го рода, играющий роль катализатора электродного процесса и токоотвода.
На аноде протекает реакция окисления водорода
H2 + 2OH‾ - 2e‾ = 2H2O,
а на катоде восстановление кислорода
½O2 + H2O + 2e‾ = 2OH‾.
В результате протекания токообразующей реакции
H2 + ½O2 = H2O
во внешней цепи протекает электрический ток, и химическая энергия превращается в электрическую.
Стандартная Э.Д.С. водородно-кислородного топливного элемента Eэ = 1,23 В. Для большинства элементов Э.Д.С. составляет 1,0 – 1,5 В.
В процессе работы электроды топливного элемента поляризуются, в результате чего Э.Д.С. элемента уменьшается. Для снижения поляризации применяют катализаторы, пористые электроды из высокодисперсных порошков металла или угля, обладающие большой площадью поверхности, увеличивают температуру протекания реакции и концентрацию электролита. В качестве катализаторов электродов топливного элемента используют Ag, металлы платиновой группы, специально обработанные никелем и кобальтом и активированный уголь. На этих электродах уже при 25 – 100 ºС достигается выcокая скорость восстановления O2 и окисления H2, поэтому их называют низкотемпературными.
Окисление природных видов топлива: нефти, газа, угля проводят в высокотемпературных топливных элементах, работающих при 500 ºС и выше. В качестве электролита в высокотемпературных топливных элементах используются или расплавы солей (Li2CO3 + Na2CO3), или твердые электролиты, например, смесь ZrO2 и Y2O3. Обычно природное топливо подвергают предварительной обработке водяным паром в присутствии катализаторов. В результате конверсии метана в присутствии катализатора получают смесь газов, содержащую водород, которую направляют в топливный элемент
![]()
![]() .
.
