
- •Элементы главной подгруппы V группы
- •Устойчивость уменьшается
- •Физические свойства:
- •Соединения азота с водородом и неметаллами:
- •Э нергетическое состояние молекулы nh3
- •700 V nh3 в 1 V жидкой воды,
- •10% Раствор аммиака называют нашатырным спиртом.
- •3. Наличие неподеленной электронной пары у атома азота придает аммиаку свойства n-донорного лиганда.
- •Химические свойства:
- •Имид лития
- •Нитрид бария
- •Свойства:
- •Кислородные соединения азота:
- •2) Восстановлением концентрированной hno3, металлами, углем, крахмалом, мышьяковистым ангидридом:
- •3) Нагреванием нитратов тяжелых металлов:
- •Гумус и неразложившиеся белки → аминокислоты → аммонификация
2) Восстановлением концентрированной hno3, металлами, углем, крахмалом, мышьяковистым ангидридом:
As2O3 + 4HNO3 = 2HАsO3 + H2O + 4NO2
3) Нагреванием нитратов тяжелых металлов:
2Pb(NO3)2 = 2PbO + 4NO2 + O2
2Hg(NO3)2 = 2Hg + 4NO2 + O2
Оксид азота (V) – азотный ангидрид, бесцветное кристаллическое вещество, расплавляется на воздухе, гигроскопично, tкип = 45,5º C, tпл = 30º C.
Получают действием фосфорного ангидрида на азотную кислоту и окислением NO2:
P2O5 + 2HNO3 = N2O5 + 2HPO3
2NO2 + O3 = N2O5 + O2
М олекула
его ассиметрична:
олекула
его ассиметрична:
Кристаллический оксид N2O5 – ионное соединение, имеющее строение (NO2)+(NO3)–.
Оксид азота (V) очень сильный окислитель. В воде хорошо растворим с образованием HNO3, со щелочами образует нитраты:
N2O5 + H2O → 2HNO3
N2O5 + 2NaOH → 2NaNO3 + H2O
При распаде N2O5 происходят процессы:
N2O5 = NO2 + NO3 (быстрая реакция)
NO3 → NO + O2 (медленная реакция)
NO3 + NO → N2O4 (быстрая реакция)
Взаимодействием N2O5 со 100%-ой H2O2 при –80º С может быть получено очень взрывчатое вещество с запахом хлорной извести - надазотная кислота HNO4.
В растворе она частично образуется при взаимодействии 100%-ой H2O2 с обычной концентрированной HNO3:
H2O2 + HNO3 = H2O + HNO4
Применение 70%-ой и еще более крепкой HNO3 вызывает разложение (сопровождается взрывом), а при концентрации ниже 20% происходит полный гидролиз HOONO2.
При испарении смеси N2O5 с избытком жидкого O3 получается очень неустойчивое белое вещество, отвечающее по составу простейшей формуле NO3, ей соответствует, также формула O2N – O – O – NO2.
Взаимодействие перекиси азота с H2O медленно идет по схеме:
2NO3 + H2O → HNO3 + HNO2 + O2,
Следует отметить, что имеющиеся данные по перекисным производным азота довольно противоречивы:
N2O4 + O3 → NO3 → N2O6
NO2 + O3 → NO3 + O2
Азотная кислота – термодинамически неустойчивое соединение:
ΔGº = 77,6 кДж.
В безводном состоянии – бесцветная жидкость,
ρ = 1,53 г/см3, tкип = 84º C, tпл = –42º C.
Безводная HNO3 слабо диссоциирует:
2HNO3 = H2NO3+ + NO3–
С водой смешивается в любых соотношениях. Промышленность выпускает HNO3 68%, ρ = 1,4 г/см3. В лабораториях концентрированная HNO3 63%.
В HNO3 азот является однозарядным положительным и четырехковалентным.
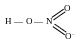
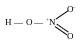
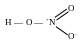
Связь трехцентровая,
т.к. соединяются три атома
Получение в лаборатории:
H2SO4 + 2NaNO3 → 2HNO3↑ + Na2SO4
конц. тв.
Промышленное производство: Pt (t=750-900º C)
1) окислением NH3 в NO: 4NH3 + 5O2 = 4NO + 6H2O
2) окислением NO в NO2: 2NO + O2 = 2NO2
3) взаимодействие с водой: 2NO2 + H2O = HNO3 + HNO2
3HNO2 = HNO3 + 2NO + H2O
фиксацией азота из воздуха:
N2 + O2 = 2NO – Q 2NO + O2 = 2NO2 + Q
2NO2 + H2O = HNO3 + HNO2
Безводная кислота на свету при повышении температуры разлагается:
hν, tº
4HNO3 → 4NO2 + O2 + 2H2O
Азотная кислота одна из самых сильных кислот.
В водных растворах она диссоциирует полностью:
HNO3 = H+ + NO3–
Азотная кислота очень сильный окислитель: окисляет фосфор, серу, углерод, металлы, разрушает животные и растительные ткани.
6HNO3 + S = 6NO2 + H2SO4 + 2H2O
конц.
5HNO3 + 3P + 2H2O = 5NO + 3H3PO4
разб.
4HNO3 + 3C = 4NO + 3CO2 + 2H2O
разб.
HNO3 + C = CO2 + 4NO2 + H2O
конц.
2HNO3 + H2S = S + 3NO2 + 2H2O
конц.
С неметаллами разбавленная HNO3 восстанавливается до NO, а концентрированная – до NO2.
В азотной кислоте растворяются многие металлы. При этом водород, как правило, не выделяется, а образуется смесь продуктов:
N+4O2 → HN+3O2 → N+2O → N+12O → N02 → N–3H3 (NH4NO3)
Схема восстановления HNO3 различной концентрации
H NO3
NO3
I II III IV V
Конц. не действует на Fe, Cr, Al, Au, Pt, Ir, Ta |
конц. с другими тяжелыми металлами до NO2 |
конц. со щелочными и щелочноземель ными металлами и Mg до N2O |
разбавл. со щелочными и щелочноземель ными металлами, Mg, а также с S и Fe до NH3 (NH4NO3) |
разбавл. с тяжелыми металлами до NO |
 Fe
+ HNO3
→пассивирует
Fe
+ HNO3
→пассивирует
конц.
Pb + 4HNO3 → Pb(NO3)2 + 2NO2 + 2H2O
Ag + 2HNO3 → AgNO3 + NO2 + H2O
конц.
4Ca + 10HNO3 → N2O + 4Ca(NO3)2 + 5H2O
конц.
4Cu + 3HNO3 → 2NO↑ + 3Cu(NO3)2 + 4H2O
разб.
4Zn + 10HNO3 → NH4NO3 + 4Zn(NO3)2 + 3H2O
очень разб.
3H2 + HNO3 → NH2OH + 2H2O
разб. гидроксиламин
Наиболее сильным окислительным действием обладает смесь:
1V конц. HNO3 + 3V конц. HCl «Царская водка»
Она растворяет даже золото. Окислительное действие царской водки обусловливается атомарным хлором:
HNO3 + 3HCl = 2Cl + 2H2O + NOCl (хлориднитрозил)
NOCl = NO + Cl
HNO3 + 3HCl = NO + 3Cl + 2H2O
Золото растворяется с образованием золотохлористоводородной кислоты:
Au + 4HCl + HNO3 = H[AuCl4] + NO↑ + 2H2O
избыток
Au + HNO3 + 3HCl = AuCl3 + NO↑ + 2H2O
3Pt + 4HNO3 + 12HCl = 3PtCl4 + 4NO↑ + 8H2O
Соли азотной кислоты – нитраты – термически неустойчивы и разлагаются:
В ряду левее Mg: 2KNO3 → 2KNO2 + O2↑
От Mg до Cu: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
Начиная с Hg: Hg(NO3)2 → Hg + 2NO2 + O2
2Ag(NO3)2 → 2Ag + 2NO2↑ + O2
Значение азота в природе и сельском хозяйстве:
Круговорот азота в природе:
орг. в-ва → NH3 → HNO3 → Ca(NO3)2
2HNO3 + CaCO3 = Ca(NO3)2 + CO2 + H2O
(орг. в-ва → N2↑ + O2 → HNO3 → Ca(NO3)2.
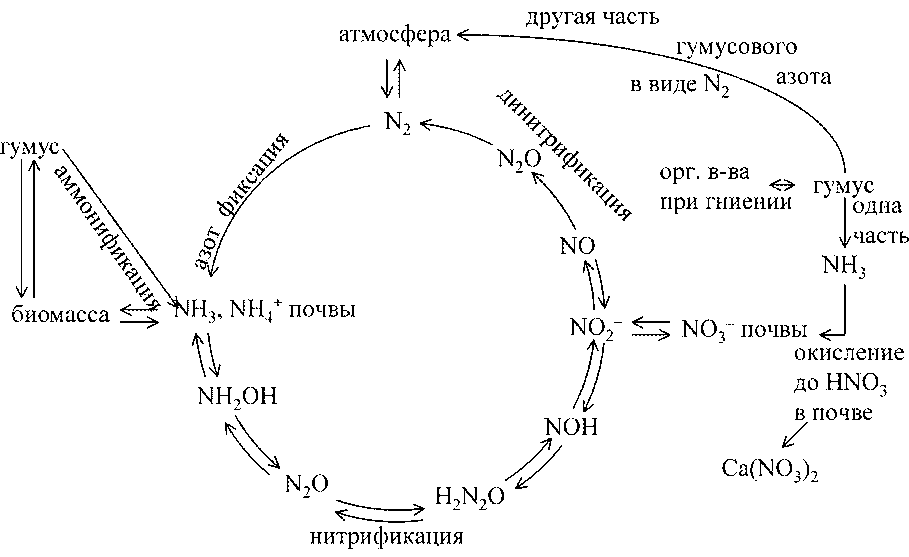
Аммонификация – превращение органического азота в аммиак и соединения аммония.
