
- •Элементы главной подгруппы V группы
- •Устойчивость уменьшается
- •Физические свойства:
- •Соединения азота с водородом и неметаллами:
- •Э нергетическое состояние молекулы nh3
- •700 V nh3 в 1 V жидкой воды,
- •10% Раствор аммиака называют нашатырным спиртом.
- •3. Наличие неподеленной электронной пары у атома азота придает аммиаку свойства n-донорного лиганда.
- •Химические свойства:
- •Имид лития
- •Нитрид бария
- •Свойства:
- •Кислородные соединения азота:
- •2) Восстановлением концентрированной hno3, металлами, углем, крахмалом, мышьяковистым ангидридом:
- •3) Нагреванием нитратов тяжелых металлов:
- •Гумус и неразложившиеся белки → аминокислоты → аммонификация
Физические свойства:
Азот не поглощает свет из-за того, что энергия фотонов видимого спектра (E = hν = 435 кДж/моль) недостаточна для возбуждения молекулы N2 (Eсв = 941 кДж/моль).
Химические свойства:
6Li + N2 → 2Li3N
t, Kат.
N2 + 3H2 → 2NH3 (t = 450-500º С, давление 30 МПа)
окис-ль
t, Кат. t, Кат.
N2 + 2B → 2BN N2 + 3Ca → Ca3N2
t = 1500º C t, kat
N2 + O2 → 2NO N2 + F2 → NF3
Восст. hν,
N2 → 2N
2N + O2 = 2NO N0 – е → N+
N+ + O2 → NO+ + O0
Соединения азота с водородом и неметаллами:
аммиак (NH3),
гидразин (H2N–NH2),
азотводородную кислоту (H[N3]).
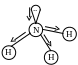
Валентные углы в соединениях азота с водородом
N
Тригональная , пирамидальная |
тригональная изогнутая,угловое строение |
NH4+
Тетраэдрическая, Тетраэдр |
Э нергетическое состояние молекулы nh3
Есвязи N – H = 391 кдж/моль
Молекулы NH3 имеют большие электрические дипольные моменты (4,44·10–30 Кл·м ),
Плотность жидкого аммиака 0,68 г/см3,
tкип (–33º С), tпл (–78º С)
700 V nh3 в 1 V жидкой воды,
при t = 0º C растворяется 1200 V NH3.
10% Раствор аммиака называют нашатырным спиртом.
Кристаллогидрат NH3·H2O (при температуре–79º).
кристаллогидрат 2NH3·H2O. NH4OH
NH3 + H2O = NH3·H2O NH3·H2O = NH4OH
NH4OH = NH4+ + OH–
Kдис. = 1,75·10–5 моль/л.
H
H H H |
| |
|
H — O ·
· · H — N · · · H — O · · · H — O · · · H — O ·
· · H — N |
| ¦ ¦
| | H
H H H H
H ¦
| | O
— H · · · O — H · · · N — H
|
| H
H
1. Наличие у атомов H положительных зарядов и электронной пары у атома N придает аммиаку способность отщеплять и присоединять протон и проявлять в растворах свойства амфолита, подобного воде (HNH2 → H+ + NH2–).
2. Ковалентный характер трех связей N–H предполагает возможность замещения водорода и на электроотрицательные и на электроположительные заместители. Аммиак и его производные способны к образованию водородных связей.

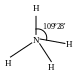 H30
H30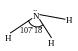 NH2-
NH2-