
- •Элементы главной подгруппы V группы
- •Устойчивость уменьшается
- •Физические свойства:
- •Соединения азота с водородом и неметаллами:
- •Э нергетическое состояние молекулы nh3
- •700 V nh3 в 1 V жидкой воды,
- •10% Раствор аммиака называют нашатырным спиртом.
- •3. Наличие неподеленной электронной пары у атома азота придает аммиаку свойства n-донорного лиганда.
- •Химические свойства:
- •Имид лития
- •Нитрид бария
- •Свойства:
- •Кислородные соединения азота:
- •2) Восстановлением концентрированной hno3, металлами, углем, крахмалом, мышьяковистым ангидридом:
- •3) Нагреванием нитратов тяжелых металлов:
- •Гумус и неразложившиеся белки → аминокислоты → аммонификация
Свойства:
NH2OH + H2O → NH3OH+ + OH– Кд = 7·10–9
Проявляет восстановительные и окислительные свойства:
2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
восст-ль щелочная среда
2NH2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (NH4)2SO4 + 2H2O
окис-ль кислая среда
Легко разлагается по механизму самоокисления-самовосстановления:
3NH2OH = NH3 + N2 + 3H2O
Азидводородная кислота H[N3]
Бесцветная жидкость, обладающая характерным резким острым запахом, tпл = –80º С, tкип = +35,7º С. Сильно взрывчатое вещество.
t = 300º С
2H[N3] = H2 + 3N2 + 564 кДж
Она имеет структуру: H – N = N ≡ N.
Азидводородная кислота несколько слабее уксусной кислоты, диссоциирует в растворе на ионы:
H[N3] = H+ + [N3]– Кд = 1,2·10–5
Соли ее азиды растворимы в воде, за исключением солей серебра, ртути и свинца, соли взрывчаты, применяются в качестве запальных взрывчатых веществ.
H[N3] является окислителем и восстановителем:
H[N3] + HNO2 → N2 + N2O + H2O
окис-ль
10H[N3] + 2KMnO4 + H2SO4 = 15N2 + K2SO4 + 2MnSO4 + 8H2O
восст-ль
H[N3] + 4H2 → 3NH3
окис-ль
H[N3] + 8KI + 8H2O → 4I2 + 3NH3 + 8KOH
Получение:
N2H4 + HNO2 = H[N3] + 2H2O
NaNH2 + N2O → H2O + NaN3
амид
затем выделение из соли: 2NaN3 + H2SO4 → Na2SO4 + 2HN3
разб. р-р
М очевина
– карбамид: аналог угольной кислоты
очевина
– карбамид: аналог угольной кислоты
Бесцветное, кристаллическое вещество, не имеющее запаха, легко возгоняется, хорошо растворима в воде и в жидком аммиаке.
П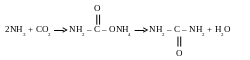 олучение:
олучение:
Г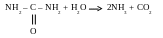 идролизуется
в щелочной и кислотной среде:
идролизуется
в щелочной и кислотной среде:
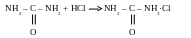
Кислородные соединения азота:
Азот образует несколько оксидов азота со степенями окисления азота:
+1, +2, +3, +4, +5:
N2O, NO, N2O3, NO2, N2O4, N2O5,
|
N2O |
NO |
N2O3 |
NO2 |
N2O4 |
N2O5 |
ΔGfº298, кДж/моль |
+104,1 |
+87,6 |
+140,6 |
+52,3 |
+79,2 |
+95,3 |
Оксиды имеют кратные или полукратные связи:
|
H2N – OH |
ON = O |
NN = O |
|
N ≡ O |
|
1 |
2 |
2 |
2,5 |
3 |
Энергия связи, кДж/моль |
280 |
468 |
535 |
631 |
1046 |
Оксиды N2O и NO несолеобразующие, остальные солеобразующие.
Оксид азота (I) N2O: tпл = –91º С, tкип = –89º С, умеренно растворим в воде.
С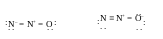 труктура
молекулы N2O
линейная. Существует в виде двух форм:
труктура
молекулы N2O
линейная. Существует в виде двух форм:
преобладает
Молекула обладает слабой полярностью с дипольным моментом.
При комнатной температуре оксид азота N2O устойчив, при нагревании разлагается:
t > 500º
2N2O → 2N2 + O2
При высокой температуре сильный окислитель, при нормальных условиях малоактивен.
Окисляет углерод, фосфор, щелочные металлы, водород, аммиак и др., в атмосфере N2O сгорают:
t t
N2O + H2 = H2O + N2 + Q 3N2O + 2NH3 = 3H2O + 4N2
t t
N2O + 2Na → Na2O + N2 2N2O + C → CO2 + 4N2
графит
t
5 N2O +2 P → P2O5 + 5N2
t
N2О + H2SO4 →2 NO + SO2 + H2O
5N2O + 2KMnO4 + 3H2SO4 → 2MnSO4 + K2SO4 + 10NO + 3H2O
Оксид азота (II) NO бесцветный, малорастворимый в воде
(1V H2O→ 0,07VNO), tпл = –152º С, tкип = –164º С.
Буреет на воздухе: NO + O2 → NO2.
При повышении tº диспропорционирует:
3
 N+2O
= N2+1
+ N+4O2
N+2O
= N2+1
+ N+4O2
Оксид азота (II) парамагнитен, электронная формула:
Тремя точками обозначена связь за счет пары связывающих и одного разрыхляющего, тогда порядок связи 0,5.
Кратность связи 2,5. Молекула NO полярна.
Он токсичен, связывает гемоглобин в крови.
С концентрированной H2SO4 образует нитрозилсерную кислоту:
4NO + O2 + 4H2SO4 = 4[NO]HSO4 + 2H2O
В лаборатории NO получают взаимодействием 30-35% азотной кислоты с медью:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
H2S + 2KNO2 + H2SO4 + 2H2O = K2SO4 + 2H2O + S + 2NO
Обладает и окислительными, и восстановительными свойствами.
t
2NO + 2H2 → 2H2O + N2 + Q
окис-ль
t
2NO + 2C → 2CO + N2
окис-ль
10NO + P4 → 2P2O5 + 5N2
окис-ль
NO + SO2 → SO3 + N2O
окис-ль
5CrCl2 + NO + 3HOH → 5Cr(OH)Cl2 + NH3
вост-ль окис-ль
В роли восстановителя вступает в реакцию с: O2, Cl2, Br2, HOCl и др.
2NO + O2 = 2NO2
2NO + Cl2 = 2[NO]Cl
2NO + K2Cr2O7 + 4H2SO4 = 2HNO3 + K2SO4 + Cr2(SO4)3 + 3H2O
Оксид азота (III) N2O3, темно-голубая жидкость, tпл = –102º С, tкип = 3,5º С, при температуре ниже –102º С превращается в светло-синие кристаллы.
М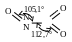 олекула
N2O3
имеет плоское строение.
олекула
N2O3
имеет плоское строение.

Стабильная модификация Нестабильная модификация
Получают N2O3 пропусканием смеси газов, образующихся при раскислении концентрированной HNO3 крахмалом через U-образную трубку, охлажденную до –30º С.
NO + NO2 = N2O3
В газообразном состоянии N2O3 неустойчив и диспропорционирует:
N2O3 = NO + NO2
С водой реагирует с образованием азотистой кислоты, со щелочами дает нитриты: N2O3 + H2O → 2HNO2
N2O3 + 2NaOH → 2NaNO2 + H2O
Для азотистой кислоты известны две таутомерии:
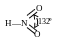
H—O—N═O
Соли ее нитриты сильные электролиты.
AgNO2.
HNO2 является окислителем и восстановителем:
2HNO2 + O2 = 2HNO3
вост-ль
5KNO2 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3H2O
вост-ль обесцвечивание р-ра
2HNO2 + H2S = 2H2O + S + 2NO
окис-ль
2KNO2 + 2KI + 2H2SO4 = I2 + 2NO + 2K2SO4 + H2O
окис-ль
Азотистая кислота диспропорционирует:
3HNO2 = HNO3 + 2NO + H2O
нитрозоаминов K2N—NO – канцерогенные вещества.
Диоксид азота NO2 бурый ядовитый газ, токсичен, легко сгущается в красноватую жидкость, tкип = 21º C, tпл = -11º C, замерзая образует бесцветные кристаллы. При понижении температуры полимеризуется: 2NO2 = N2O4.
Молекула NO2 нелинейная, ее неспаренный электрон находится на связывающей орбитали, что и определяет склонность к димеризации:
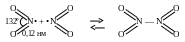
-
Бурый газ,
парамагнитен
Бесцветный кристалл, диамагнитен
Порядок связи 1,5, sp2-гибридизация азота. Длина связи 0,12 нм занимает промежуточное положение между одинарной (0,143 нм) и двойной (0,118 нм).
Молекула NO2 окислитель и умеренный восстановитель:
2NO2 + 7H2 = 4H2O + 2NH3
окис-ль
2NO2 + F2 + 2H2O = 2HNO3 + 2HF
вост-ль
При растворении в воде образует азотную и азотистые кислоты, а в щелочах их соли.
2NO2 + H2O = HNO3 + HNO2
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Азотистая кислота сразу же разлагается:
3HNO2 = HNO3 + 2NO + H2O
Получение:
1) окислением кислородом при обыкновенной температуре: 2NO + O2 = 2NO2.
