
- •Элементы главной подгруппы V группы
- •Устойчивость уменьшается
- •Физические свойства:
- •Соединения азота с водородом и неметаллами:
- •Э нергетическое состояние молекулы nh3
- •700 V nh3 в 1 V жидкой воды,
- •10% Раствор аммиака называют нашатырным спиртом.
- •3. Наличие неподеленной электронной пары у атома азота придает аммиаку свойства n-донорного лиганда.
- •Химические свойства:
- •Имид лития
- •Нитрид бария
- •Свойства:
- •Кислородные соединения азота:
- •2) Восстановлением концентрированной hno3, металлами, углем, крахмалом, мышьяковистым ангидридом:
- •3) Нагреванием нитратов тяжелых металлов:
- •Гумус и неразложившиеся белки → аминокислоты → аммонификация
Устойчивость уменьшается
осн. св-ва → слабоосновные → не проявл-ся
N2O3, P2O3 , Bi2O3 , As2O3 и Sb2O3
гидроксиды НЭО3 и Н3ЭО4
Азот
Азот открыт в 1772 г. шотландским ученым Даниэлем Резерфордом. получен К. Шееле, Дж. Пристли, Г. Кавендишем.
По распространенности азот занимает 20 место.
В атмосфере его около 78 об.%, что составляет 4·1015 тонн.
В земной коре азот:
чилийская селитра (NaNO3),
индийской селитры (KNO3).
Без белка нет жизни, а без азота нет белка.
Природные изотопы: 14N (99,635 масс.%) и 15N (0,365 масс.%).
Искусственно получены радиоактивные изотопы: 12N, 13N, 16N, 17N.
Наиболее долго живущий изотоп 13N (Т½ = 9,93 мин.).
нитриды (BN, AlN, Si3N4, TiN).
Комплексы переходных металлов, содержащие связанный молекулярный азот, например: [Ru(NH3)5N2]2+, [Fe(CN)5N2]3–.
Способы получения азота:
1. В промышленности получение азота осуществляется ректификацией жидкого воздуха.
Жидкий кислород tкип (–183º С), азот (–196º С).
2. В промышленности азот выделяют из воздуха, пропуская его через раскаленный железный лом.
3. Метод получения азота из воздуха по способу Брина основан на поглощении кислорода воздуха оксидом бария или пирогаллолом.
BaO + воздух (O2, N2) = BaO2 + N2
В лабораторных условиях:
4. Азот получают пропусканием NH3 над раскаленным оксидом меди (II):
tº
2N-3H3 + 3Cu2+O → N20 + 3H2O + 3Cu0
вос-ль окис-ль
5. Разложением нитрита аммония:
tº
NH4NO2 → N2 + 2H2O
6. Разложением дихромата аммония:
(NH4)2Cr2O7 → N2 + Cr2O3 + 4H2O
Строение молекулы N2. Химическая связь в молекуле.
2N = N2 + 941 кДж/моль
Тройная связь в молекуле N2 по энергии эквивалентна почти шести одинарным связям N – N. Очень прочной является первая из разрываемых в молекуле N2 связей – σ связующая (522,5 кДж/моль).
Электронное строение N2.
По методу ВС: молекулу N2 (:N ≡ N:)
Схема молекулярных орбиталей молекулы N2:
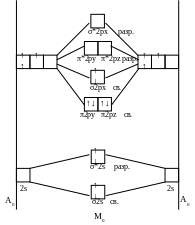
Е связи N ≡ N равно 941 кдж/моль
941 – 522 = 419 : 2 = 208 кдж/моль
8 св - 2 разрыхл. = 3 кратность связи
2
Энергии связи атомов
Связь |
N–H |
N–C |
N=C |
N–N |
N–O |
N=O |
N–F |
Энергия, кДж/моль |
391 |
292 |
615 |
163 |
201 |
607 |
272 |
Связь |
P–H |
P–C |
P=C |
P–N |
P–O |
P=O |
P–F |
Энергия, кДж/моль |
322 |
272 |
– |
– |
415 |
584 |
490 |
σ
N ≡ N
2π
Длина связи в N2 = 0,109 нм
Суммарная энергия тройной связи в N2 941 кДж/моль.
Характерные степени окисления:
N03 - азот
N–3H3 – аммиак
(N–3H4)2SO4 – соль аммония
Na+N–3H+2 – амид натрия
N–1H2+O–2H+ – гидроксиламин
N2+1O – оксид азота (I)
N+2O – оксид азота (II)
H+3NO2 – азотистая кислота
K3+NO2 – соль азотистой кислоты
N+4O2 – оксид азота (IV)
H+5NO3 – азотная кислота
KNO3 – соль азотной кислоты
