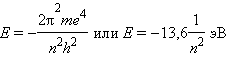- •1. Уравнение Лагранжа примеры его составления. Функция Лагранжа, ее свойства.
- •Свойства функции Лагранжа
- •2. Законы сохранения, соответствующие фундаментальным симметриям: энергия, импульс, момент импульса.
- •В общем случае теорема об изменении обобщенной энергии имеет вид
- •3. Канонические уравнения Гамильтона. Первые интегралы уравнений Гамильтона. Эквивалентность лагранжевого и гамильтонового формализма.
- •4. Движение в центральных полях. Кеплерова задача. Параметрическое уравнение. Траектории движения.
- •5. Уравнения Максвелла.
- •6. Проводники и диэлектрики.
- •7. Граничные условия для векторов электрического поля.
- •7.3. Условия для касательных составляющих векторов и
- •8. Граничные условия для векторов магнитного поля
- •9. Скалярный и векторный потенциалы заряда, движущегося с постоянной скоростью; формула Лоренца.
- •10. Преобразования Лоренца для проекций векторов и . Инварианты электромагнитного поля.
- •11. Полное описание квантовой системы. Принцип суперпозиции. Ортогональность и нормировка собственных функций эрмитовых операторов. Базис пространства состояний. Чистые и смешанные состояния.
- •13. Общие свойства решений одномерного уравнения Шрёдингера. Частица в прямоугольной потенциальной яме бесконечной и конечной "глубины". Спектр энергии и собственные функции.
- •14. Квантовое движение в центральном поле. Состояния электрона в поле ядра. Атом водорода и водородоподобные ионы. Квантовые числа.
- •15. Гармонический осциллятор в энергетическом представлении. Операторы рождения и уничтожения. Спектр энергии и собственные функции.
- •Общие условия равновесия и устойчивости
- •Равновесие гомогенной системы
- •18. Фазовые переходы. Фазовые переходы 1-го рода. Уравнение Клапейрона-Клаузиуса. Фазовые переходы 2-го рода. Уравнение Эренфеста. Критические и закритические явления.
14. Квантовое движение в центральном поле. Состояния электрона в поле ядра. Атом водорода и водородоподобные ионы. Квантовые числа.
Решение уравнения Шредингера для водородоподобного атома имеет фундаментальное значение, т.к. получаемые здесь результаты служат основой для изучения многоэлектронных систем.
Разделение переменных в сферической системе координат
Водородоподобный атом содержит одно ядро и один электрон. Заряд электрона равен -е, заряд ядра +Zе, где Z - порядковый номер элемента. Потенциальная энергия этой системы двух частиц является функцией только расстояния между ними и выражается энергией кулоновского притяжения
![]() (1)Гамильтониан системы запишется
в виде
(1)Гамильтониан системы запишется
в виде
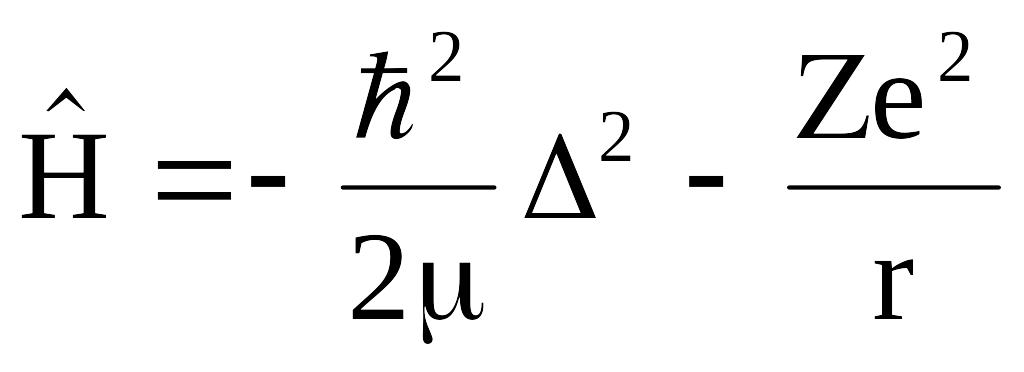 (2)
(2)
для решения уравнения Шредингера
 (3)
(3)
целесообразно выразить его в сферических координатах, используя оператор Лапласа, преобразованный к сферической системе координат Подставляя его в (3) и переходя к y (r, q, j), имеем:
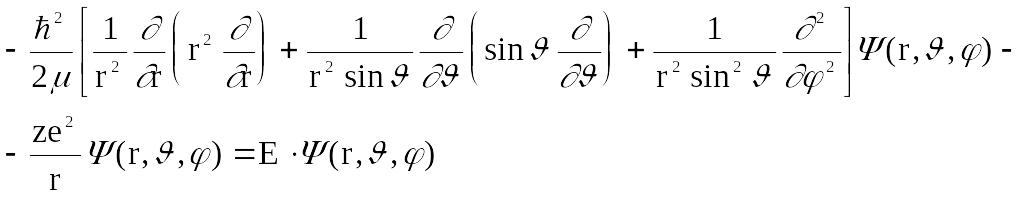 (4)
(4)
![]() Это
дифференциальное уравнение в частных
производных второго порядка удобно
решить, разделяя переменные. Для этого
будем искать его решение в виде
Это
дифференциальное уравнение в частных
производных второго порядка удобно
решить, разделяя переменные. Для этого
будем искать его решение в виде
![]() =
R(r)·
=
R(r)·
![]() (5)
(5)
Разделяя переменные в уравнении Шредингера в сферических координатах, получили три уравнения, каждое из которых зависит от одной лишь переменной: это
Ф-уравнение
 (6)
(6)
R- уравнение:
![]() (7)
(7)
и
![]() - уравнение:
- уравнение: ![]()
Нормированная функция
![]() (
(![]() ),
таким образом, имеет вид
),
таким образом, имеет вид
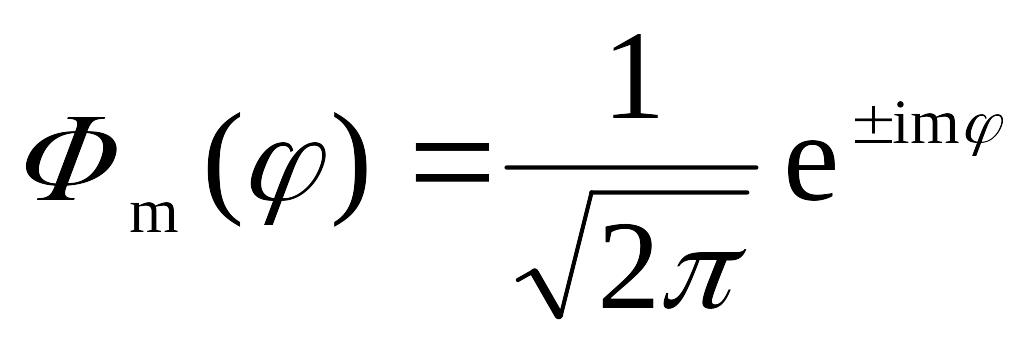 (8)
(8)
Возможные значения параметра m найдем
из условия однозначности функции
(
):
![]() или
или
 ,
т.е.
,
т.е.
![]() .
.
К последнему выражению применим формулу Эйлера
![]()
![]() =
cos kx
=
cos kx
![]() i sin kx,
имеем cos2
i sin kx,
имеем cos2![]() m
isin2
m
= 1
m
isin2
m
= 1
Синус при всех углах
![]() 2
m
должен быть равным нулю, а косинус -
единице. А это возможно лишь при условии
m = 0,
2
m
должен быть равным нулю, а косинус -
единице. А это возможно лишь при условии
m = 0,
![]() (9)
(9)
Мы получили первое квантовое число m, которое может принимать только целочисленные значения, положительные и отрицательные, в том числе и нуль.
Квантовое число n – главное. Оно определяет энергию электрона в атоме водорода и одноэлектронных системах (He+, Li2+ и т. д.). В этом случае энергия электрона
|
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном.
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или уровень, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д.
Орбитальное квантовое число l характеризует форму орбиталей и принимает значения от 0 до n – 1. Кроме числовых l имеет буквенные обозначения
l |
= |
0 |
1 |
2 |
3 |
4 |
… |
l |
= |
s |
p |
d |
f |
g |
… |
Электроны с одинаковым значением l образуют подуровень.
Квантовое число l определяет
квантование орбитального момента
количества движения электрона
![]() в
сферически симметричном кулоновском
поле ядра.
в
сферически симметричном кулоновском
поле ядра.
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2l + 1 значений. Расположение орбитали характеризуется значением проекции вектора орбитального момента количества движения Mz на какую-либо ось координат (обычно ось z):
|
Все вышесказанное можно представить таблицей:
Орбитальное квантовое число
|
||||||||||||||||||
Таблица 1. Число орбиталей на энергетических подуровнях. |
Орбитали одного подуровня (l = const) имеют одинаковую энергию. Такое состояние называют вырожденным по энергии. Так p-орбиталь – трехкратно, d – пятикратно, а f – семикратно вырождены.
s-Орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально симметричная форма обусловлена тем, что при l = 0 и μl = 0.
p-Орбитали существуют при n ≥ 2 и l = 1, поэтому возможны три варианта ориентации в пространстве: ml = –1, 0, +1. Все p-орбитали обладают узловой плоскостью, делящей орбиталь на две области, поэтому граничные поверхности имеют форму гантелей, ориентированных в пространстве под углом 90° друг относительно друга. Осями симметрии для них являются координатные оси, которые обозначаются px, py, pz.
d-Орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1, 0, +1, +2, то есть характеризуются пятью вариантами ориентации в пространстве. d-Орбитали, ориентированные лопастями по осям координат, обозначаются dz² и dx²–y², а ориентированные лопастями по биссектрисам координатных углов – dxy, dyz, dxz.
Семь f-орбиталей, соответствующих l = 3 (n ≥ 4), изображаются в виде граничных поверхностей, приведенных на рис. 2.1.
Квантовые числа n, l и ml не
полностью характеризуют состояние
электрона в атоме. Экспериментально
установленно, что электрон имеет еще
одно свойство – спин. Упрощенно спин
можно представить как вращение электрона
вокруг собственной оси. Спиновое
квантовое число ms имеет
только два значения ms = ±1/2,
представляющие собой две проекции
углового момента электрона на выделенную
ось. Электроны с разными ms обозначаются
стрелками, направленными вверх
![]() и
вниз
и
вниз
![]() .
.
В многоэлектронных атомах, как и в атоме водорода, состояние электрона определяется значениями тех же четырех квантовых чисел, однако в этом случае электрон находится не только в поле ядра, но и в поле других электронов. Поэтому энергия в многоэлектронных атомах определяется не только главным, но и орбитальным квантовым числом, а вернее их суммой: энергия атомных орбиталей возрастает по мере увеличения суммы n + l; при одинаковой сумме сначала заполняется уровень с меньшим n и большим l. Энергия атомных орбиталей возрастает согласно ряду
|
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s ≈ 5f ≈ 6d < 7p. |
|
Итак, четыре квантовых числа описывают состояние электрона в атоме и характеризуют энергию электрона, его спин, форму электронного облака и его ориентацию в пространстве. При переходе атома из одного состояния в другое происходит перестройка электронного облака, то есть изменяются значения квантовых чисел, что сопровождается поглощением или испусканием атомом квантов энергии.