
- •2. Принцип относительности в классической механике. 1 з-н Ньютона. Исо. Принцип относительности Галилея, их следствия. Инвариантные и неинвариантные величины.
- •3. Классическая динамика мт. Взаимодействие тел. Понятие силы и массы. Силы в механике. Законы Ньютона. Границы их применимости. Принцип причинности в классической динамике.
- •4. Закон сохранения полной механической энергии. Механическая работа. Кинетическая и потенциальная энергия. Закон сохранения механической энергии
- •6.Закон сохранения момента импульса.
- •7. Закон всемирного тяготения. Открытие Ньютоном закона всемирного тяготения. Опыты Кавендиша. Инертнаяигравитационная массы. Гравитационное поле. Гравитационное взаимодействие в природе.
- •8. Движение частиц в центральном поле. Центральные поля. Задача двух тел и приведенная масса. Задача Кеплера.Космические скорости.
- •Задача двух тел. Приведённая масса.Кеплерова задача.
- •9. Механические колебания. Характеристики колебательного движения. Свободные и вынужденные колебания линейного гармонического осциллятора. Колебания при наличии трении. Резонанс
- •10. Движ-е в неинерциальных со. Нисо. Силы инерции в поступательно движ-ся системе. Принцип эквивалентности сил инерции и сил тяготения.
- •12. Основы мкт теории газов. Основное уравнение мкт. Статистическое истолкование температуры и давления. Уравнение менделеева-клапейрона. Изотермы реального и идеального газа.Уравнение вдв.
- •13 Теплоемкость газов и тв тел.
- •14 Распределение Максвела–Больцмана.
- •15.Второе начало термодинамики.
- •16 Фазовые переходы
- •17. Основные законы электростатики.
- •21. Электрический ток в металлах.
- •22. Элементы зонной теории твердого тела.
- •23. Электрический ток в полупроводниках.
- •24. Магнитное поле постоянного тока.
- •25. Вещество в магнитном поле
- •26.Электромагнитная индукция (эи)
- •27. Уравнения Максвелла.
- •28.Перем. Эл. Ток
- •30. Интерференция световых волн
- •35.Специальная теория относительности(сто)
12. Основы мкт теории газов. Основное уравнение мкт. Статистическое истолкование температуры и давления. Уравнение менделеева-клапейрона. Изотермы реального и идеального газа.Уравнение вдв.
1. Кинетическая модель идеального газа. С точки зрения МКТ абсолютно идеальным является газ, представляющий собой сист из огромного числа м. т., то есть бесконечно малых частиц, не взаимод между собой и не сталкивающихся друг с другом.
При таких допущ частицы ид. Г. должны считаться совершенно свобод. Это значит, что движутся они прямолинейно и равном от одного соуд со стенкой сосуда до другого. Каждая частица ид. Г. ведет себя так, как будто других частиц вокруг нее нет.
Физические законы и следствия, которым ид. газы подчиняются точно, справедливы с опред погрешностью и для реальных газов.
2. Основное уравнение кинетической теории газов. Поскольку газ есть система из хаотически движущихся с разными скоростями молекул, то можно предположить, что давление газа на стенки сосуда есть результат множества соударений молекулы со стенками. Поэтому должна быть определенная количественная связь между средними параметрами движения молекул и величиной давления.
Скорости молекул газа различны по величине. В действительности скорости молекул газов разные не только по направлению, но и по величине.
Предположим, что
газ состоит из нескольких групп
молекул. Массы всех молекул
одинаковы и равны m,
а скорости молекул одинаковы по величине
лишь в пределах групп. Пусть в
группе 1 – скорости молекул
![]() ,
в группе 2 – скорости молекул
,
в группе 2 – скорости молекул
![]() ,…
в группе i
скорости молекул
,…
в группе i
скорости молекул
![]() .
.
Парциальное давление
газа каждой группы определится также
формулой :
![]() ,
где
,
где
![]() - концентрация молекул газа в i-той
группе.
- концентрация молекул газа в i-той
группе.
По закону Дальтона
для парциальных давлений суммарное
давление газа в целом есть сумма
парциальных давлений,![]() .
.
Сумму можно
представить так:
![]() ,
где n
– концентрация всех молекул газа, а
,
где n
– концентрация всех молекул газа, а
![]() - средний квадрат проекции скорости
всех молекул.
- средний квадрат проекции скорости
всех молекул.
Заметим, что число
групп молекул в единице объема может
достигать
![]() . То
есть каждая молекула может иметь отличную
от других молекул скорость, так что
число групп будет равно числу молекул.
Итак,
. То
есть каждая молекула может иметь отличную
от других молекул скорость, так что
число групп будет равно числу молекул.
Итак,
![]()
здесь входит средний квадрат проекции скорости.
Перейдем от проекции
скорости
![]() к модулю скорости u.
Вектор скорости любой молекулы можно
представить как сумму составляющих по
осям.
к модулю скорости u.
Вектор скорости любой молекулы можно
представить как сумму составляющих по
осям.
![]() ,
,
или
![]() .
.
Направления
скоростей равновероятны. Поэтому
средние квадраты для системы с большим
числом частиц одинаковы,
![]() . Тогда
. Тогда![]() ,
,![]() .
.
Подставляем. ![]() .
.
![]() Основное
уравнение кинетической теории газов
Основное
уравнение кинетической теории газов
Давление в газах
пропорционально концентрации молекул
n
и их средней кинетической энергии
![]() хаотического поступательного движения.
хаотического поступательного движения.
Температура T и давление p - статистические величины. Эти понятия применимы лишь к системам с огромным числом молекул, соизмеримым с числом Авогадро NA = 6,0221023 моль1
Св-ва газа как
системы частиц не сводимы к свойствам
отдельных молекул. Такая система
проявляет новые качества и хар-ся новыми
физическими величинами – давлением p
и температурой T. Здесь
проявляется диалектический
закон перехода количества в
качество. Свойства
газов определяются усредненными
параметрами молекул – средней кинетической
энергией
![]() ,
средней скоростью
,
средней скоростью
![]() ,
средним импульсом
,
средним импульсом
![]() . Средние
величины находятся методами
статистики. Раздел физики, методом
исследования в котором является
статистика, называется статистической
физикой.
. Средние
величины находятся методами
статистики. Раздел физики, методом
исследования в котором является
статистика, называется статистической
физикой.
Основное уравн
МКТ для ид.г. уст связь м/д
макропараметромпараметром Р и
микропарам-ми
![]() ,
но для решения
практич задач важно знать связь м/д
макропараметрами Р,V,T,m.
Уравнение Менделеева-Клапейрона.
,
но для решения
практич задач важно знать связь м/д
макропараметрами Р,V,T,m.
Уравнение Менделеева-Клапейрона.
![]() ,
где
R=Nak=8,31Дж/мольК-унирерсальая
газовая постоянная.
,
где
R=Nak=8,31Дж/мольК-унирерсальая
газовая постоянная.
k = 1,381023 Дж/К.
Газ холод-ый и
плотный не будет подчин-ся уравнению
Мен-Клап. РГ подчин-ся Ур-ию Ван-дер-Ваальса.
![]() ,
а для одного моля в-ва
,
а для одного моля в-ва
![]() .
Здесь b-
поправка на собст-ый объем мол-л
.
Здесь b-
поправка на собст-ый объем мол-л![]() где N-
число всех м-кул. Поправка а учитывает
взаим-ие притяжения (зависит от газа).
Притяжение м/у мол-ми приводит к тому,
что поверх-ый слой стяг-ся внутрь, создает
добавочное давление. Уравнение В-Д-В
хорошо работает для достаточно нагретого
и не очень плотного газа. Но для хол-го
и плотного его точность плохая. тем не
менее на кач-ом уровне оно работает и в
этой обл-ти и даже до некот-ой степени
опис-т пер-од Ж-Г и обратно. Наглядно РГ
и ИГ м/о показать на изотерме этих газов.
где N-
число всех м-кул. Поправка а учитывает
взаим-ие притяжения (зависит от газа).
Притяжение м/у мол-ми приводит к тому,
что поверх-ый слой стяг-ся внутрь, создает
добавочное давление. Уравнение В-Д-В
хорошо работает для достаточно нагретого
и не очень плотного газа. Но для хол-го
и плотного его точность плохая. тем не
менее на кач-ом уровне оно работает и в
этой обл-ти и даже до некот-ой степени
опис-т пер-од Ж-Г и обратно. Наглядно РГ
и ИГ м/о показать на изотерме этих газов.
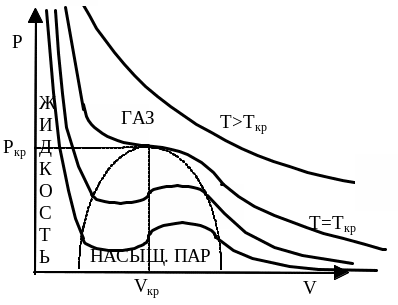
Штриховая кривая разделяет три фазы. При Т>Tкр изотерма мало отл-ся от гиперболы. По мене понижения темпер-ры изотерма пара стан-ся все более похожей на куб-ую параболу. Если изотермически сжимать ненесыщ-ый пар при Т<Ткр, то конц-ия молекул возрастет и соотв-но, давление будет возрастать вплоть до давления насыщ-го пара. При дальн-ем уменьшении объема на дне сосуда образ-ся жидкость и устан-ся динам-ое равновесие м/у нас-ым паром и жидкостью. Давление нас-го пара ост-ся неизменным, а с уменьшением объема все большая часть пара перех-т в жидкость. Гориз-ый участок на изотерме обусловлен процессом превр-ия части пара в жидкость. Ур-ие М-Кл с дост-ой степенью точности выполн-ся, но надо помнить, что масса пара не ост-ся при сжатии пост-ой. Процесс умен-ия объема при дальн-ем сжатии прекр-ся, когда весь газ в сосуде превр-ся в жидкость. Резкое возр-ие давления при дальнейшем уменьшении объема объясн-ся малой сжим-стью жидкости.
