
- •Физические свойства бензола.
- •Способы получения бензола
- •Химические свойства бензола.
- •Реакции электрофильного замещения в бензоле
- •Влияние заместителей на скорость и направление реакций электрофильного и нуклеофильного замещения в бензольном ряду
- •Электроноакцепторные заместители
- •Нуклеофильное замещение атомов галогенов в бензольном ядре
- •Реакции активированного нуклеофильного замещения с аммиаком и аминами
- •Электронодонорные заместители
- •Пространственное влияние на направление химической реакции
- •Согласованное и несогласованное влияние заместителей
- •Особая группа заместителей
- •Наиболее важные производные ароматических углеводородов
- •Способы получения фенола и его аналогов
- •Электронное и пространственное строение фенола.
- •Химические свойства фенолов
- •Ароматические амины
- •Алкилирование натрового производного ацетанилида галогенпроизводными алканов:
- •Гидролиз n-алкильного производного ацетанилида
- •Содержание
Ароматические амины
Ароматические амины – очень важный класс соединений. Достаточно сказать, что по названию простейшего их представителя – анилина долгое время называлась целая отрасль химической промышленности – анилинокрасочная и главные целевые её продукты – анилиновые красители.
Ароматические амины как правило получают из ароматических нитросоединений. Ещё в 1842 году Николай Николаевич Зинин опубликовал в немецком химическом журнале статью, в которой привёл данные о получении анилина из нитробензола, 2-нафтиламина из 2-нитронафталина и м-аминобензойной кислоы из м-нитробензойной действием сульфида аммония. В качестве примера приведём восстановление п-нитрохлорбензола до п-хлоранилина:

Через 12 лет в 1854 году французский химик Бешан предложил другой метод восстановления ароматических нитросоединений: чугунными стружками в кислой среде или в среде электролитов:

При восстановлении ароматических нитросоединений в нейтральной среде электролитами могут быть хлориды натрия, кальция, железа(II), аммония, сульфат железа(II). Железо при этом окисляется до железной окалины – Fe3O4. Реакция сильно экзотермична:
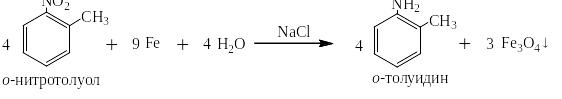
Оба способа восстановления ароматических нитросоединений до аминов и по Зинину, и по Бешану до сих пор являются промышленными и очень широко применяются в синтезах красителей и лекарственных препаратов. Однако в этих способах образуется большое количество сточных вод, а в способе Бешана ещё и плохо фильтрующийся шлам железной окалины – Fe3O4, который из-за наличия в нём токсичных органических примесей наотрез отказываются брать металлурги, хотя массовая доля железа в нём больше, чем во многих рудах. В связи с этим очень перспективным является восстановление ароматических нитросоединений водородом на катализаторе – никеле Ренея. Реакция ведётся в спирте, который используется многократно, сточных вод нет.

Полученные из нитросоединений первичные ароматические амины могут быть проалкилированы до вторичных или до третичных жирноароматических аминов. Алкилирование первичных ароматических аминов до симметричных третичных аминов протекает просто – путём прямого взаимодействия с двумя молями галоидного алкила в присутствии такого же количества соды или поташа (или их избытка):


, наоборот, представляет определённые трудности. Дело в том, что при замене первого атома водорода на алкил основность нового вторичного жирно-ароматическкого амина становится на порядки выше, чем у исходного первичного, и он алкилируется до третичного в 1000 – 10000 раз быстрее. На практике, если к одному молю первичного ароматического амина добавить один моль галоидного алкила, то получится почти полмоля симметричного третичного амина, доли процента целевого вторичного жирно-ароматического амина и останется полмоля не прореагировавшего первичного ароматического амина. В связи с этим получить вторичный жирно-ароматический амин с хорошим выходом можно лишь проведя четырёхстадийный синтез, состоящий из следующих стадий:
Постановка защитной группы путём ацилирования аминогруппы первичного ароматического амина:
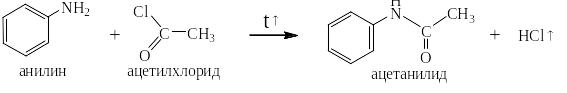
Полученный на этой стадии ацетанилид или его гомологи и аналоги являются типичными N – H-кислотами за счёт электроноакцепторного влияния как карбонильной группы, так и бензольного ядра. Поэтому атом водорода при атоме азота можно легко заменить на активный металл
Получение натрового производного ацетанилида или его гомолога или аналога:

Эту реакцию чаще всего проводят при 110 – 115оС в смеси ксилолов, которая при этой температуре ещё не кипит. Полученное натровое производное исключительно легко реагирует с галоидными алкилами.
