
- •Физические свойства бензола.
- •Способы получения бензола
- •Химические свойства бензола.
- •Реакции электрофильного замещения в бензоле
- •Влияние заместителей на скорость и направление реакций электрофильного и нуклеофильного замещения в бензольном ряду
- •Электроноакцепторные заместители
- •Нуклеофильное замещение атомов галогенов в бензольном ядре
- •Реакции активированного нуклеофильного замещения с аммиаком и аминами
- •Электронодонорные заместители
- •Пространственное влияние на направление химической реакции
- •Согласованное и несогласованное влияние заместителей
- •Особая группа заместителей
- •Наиболее важные производные ароматических углеводородов
- •Способы получения фенола и его аналогов
- •Электронное и пространственное строение фенола.
- •Химические свойства фенолов
- •Ароматические амины
- •Алкилирование натрового производного ацетанилида галогенпроизводными алканов:
- •Гидролиз n-алкильного производного ацетанилида
- •Содержание
Реакции электрофильного замещения в бензоле
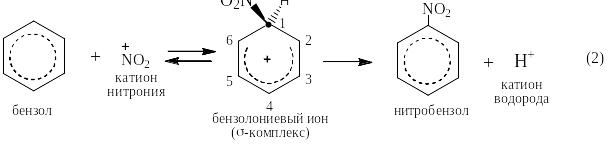
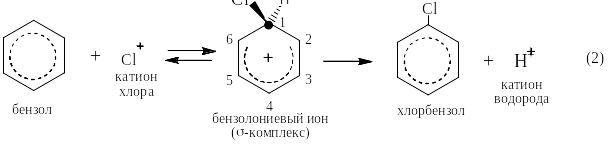
Реакциями электрофильного замещения называются такие реакции, в которых атакующей частицей является катион (А+), а уходящей так же катион (чаще всего Н+). Реакции ЭФ-замещения в бензоле идут по единому механизму: из бензола и катиона А+ обратимо образуется бензолониевый ион, который называют также σ-комплексом, так как в нём возникает новая σ-связь С – А, а положительный заряд делокализуется по «бензольному» ядру. Атом углерода С(1) в бензолониевом ионе находится в состоянии sp3-гибридизации, а атомы от С(2) до С(6) остаются в состоянии sp2-гибридизации, образуя единое π-облако, напоминающее таковое в бутадиене. σ-комплекс является очень сильной кислотой и необратимо отщепляет протон, превращаясь в производное бензола с заместителем А. При этом восстанавливается единое π-облако из шести p-электронов:
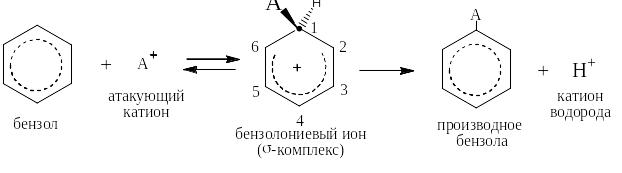
К реакциям электрофильного замещения относятся, например, реакции сульфирования, нитрования, галогенирования, реакции алкилирования и ацилирования по Фриделю-Крафтсу и реакция азосочетания.
Реакция сульфирования протекает в три стадии: на первой две молекулы серной кислоты реагируют друг с другом: одна как кислота, а вторая как основание. При этом образуются обратимо вода, гидросульфат-анион и катион сульфония:

На второй стадии катион сульфония нападает на бензол с образованием σ-комплекса, который затем разрушается с выделением катиона водорода и получением конечного целевого продукта – безолсульфокислоты:
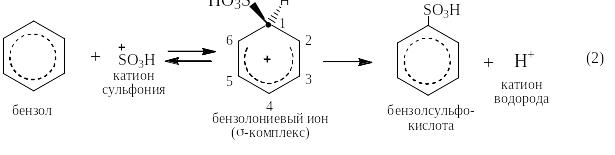
На третьей стадии катион водорода со второй и гидросульфат-ион с первой стадии, реагируя друг с другом, образуют серную кислоту:
![]()
Таким образом серная кислота – «основание» является реагентом, так как её фрагмент входит в состав конечного продукта, а серная кислота – «кислота» является катализатором, так как, поучаствовав в реакции, она в неизменном количестве возвращается в реакционную массу.
При описании синтезов реакции сульфирования записывается следующим образом:
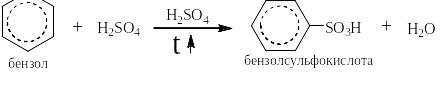
Серная кислота над стрелкой показывает её роль в реакции как катализатора и как растворителя.
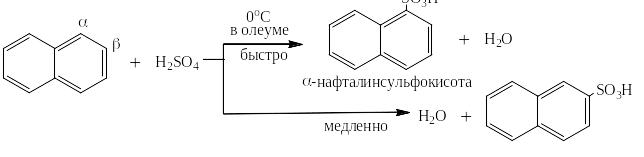
Аналог бензола -- нафталин в зависимости от условий проведения реакции сульфируется в различные положения: при сульфировании олеумом при 0оС катион сульфония на несколько порядков быстрее идёт в α-положение нафталина, чем в β. Наблюдается так называемый «кинетический контроль» в реакции.
![]()
Если же вести реакцию долго в 92% серной кислоте, где воды по молям всего вдвое меньше, чем серной кислоты, и где реакция сульфирования становится обратимой, то высокоселективно получается β-изомер, в сторону которого смещено равновесие – «термодинамический контроль»:

Реакция нитрования протекает по аналогичному сульфированию механизму. «Основанием» в ней является азотная кислота (её pKa = -1,6), a «кислотой» - серная кислота (её pKa = -3), так как она примерно в 30 раз сильнее азотной.

При описании синтезов реакции нитрования записывается следующим образом:
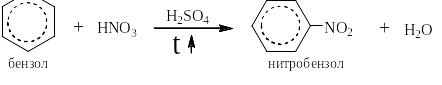
Серная кислота является здесь и катализатором и растворителем. Её берут в количестве 16 – 20 молей на моль реагента – азотной кислоты. Скорость нитрования на несколько порядков выше скорости сульфирования в тех же условиях, так что получением сульфокислот можно пренебречь.
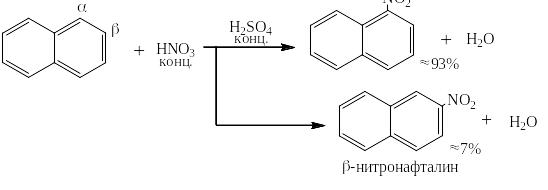
В нафталине не удаётся селективно получить какой-либо один изомер:
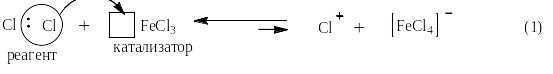
Под реакцией галогенирования понимают реакции прямого введения хлора или брома в бензольное (или нафталиновое) ядро в присутствии катализатора. Фтор даже при -100оС сжигает органические вещества до CF4 и HF. Йод наоборот не реагирует с производными бензола и нафталина. Галогенирование подобно реакциям сульфирования и нитрования так же проходит в три стадии: на первой катализатор – галогенид железа (III) гетеролитически разрывет молекулу галогена, образуя атакующую частицу для второй стадии – галогенидный катион. Последний, реагируя с бензолом, даёт σ-комплекс и далее целевой продукт – галогенпроизводное бензола. На третьей стадии катион водорода со второй реагирует с галогенидным комплексом железа с первой стадии и в реакционную массу возвращается катализатор:
![]()
При описании синтезов реакции галогенирования записываются следующим образом:
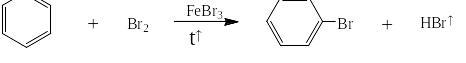
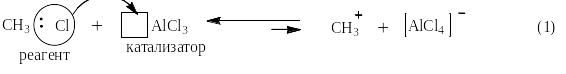
Под реакцией алкилирования по Фриделю-Крафтсу понимают реакции прямого введения алкильных остатков в бензольное (или нафталиновое) ядро в присутствии катализатора – безводного хлорида алюминия. При этом на арен действуют либо галоидным алкилом (галогеналканом), либо алкеном. Ниже представлен трехстадийный механизм для случая алкилирования метилхлоридом:
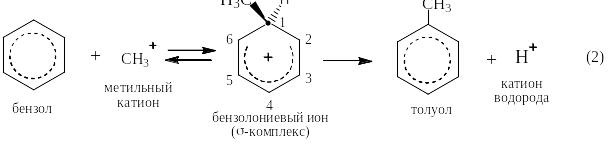
![]()
При описании синтезов реакции алкилирования записываются, например, следующим образом:
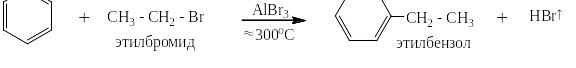
Или в случае реакции с алкенами:
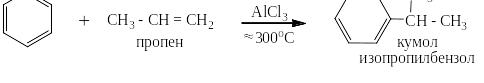
Реакции алкилирования проходят при высоких температурах в присутствии катализатора, способствующего так же и реакции изомеризации алканов. Поэтому, если действовать на бензол длинным линейным галогеналканом с атомом галоида на конце цепи, получаются изомерные алкилбензолы, например:
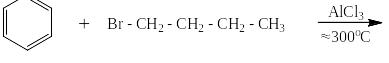
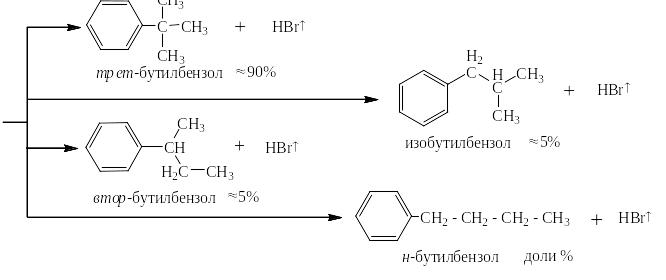
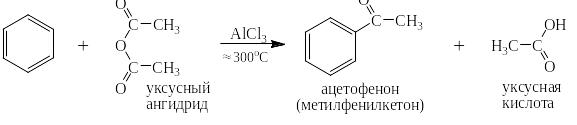
Под реакцией ацилирования по Фриделю-Крафтсу понимают реакции прямого введения ацильных остатков в бензольное (или нафталиновое) ядро в присутствии катализатора – безводного хлорида алюминия. При этом на арен действуют либо галогенангидридом кислоты, либо её ангидридом. Ниже представлен трехстадийный механизм для случая ацилирования хлорангидридом уксусной кислоты (хлористым ацетилом):
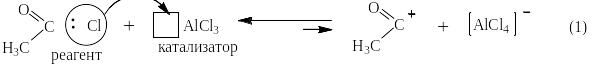
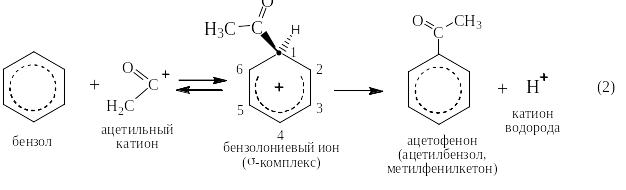
![]()
Реакции ацилирования проходят при значительно менее высоких температурах, чем реакция алкилирования. Скорость реакций изомеризации при таких температурах ничтожно мала. Поэтому можно ацилировать бензол (и тем более нафталин) галогенангидридами с длинными линейными алкильными радикалами, например:
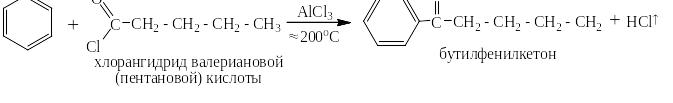
Из таких кетонов можно получить длинные линейные алкилбензолы, нпапример, по Клемменсену:
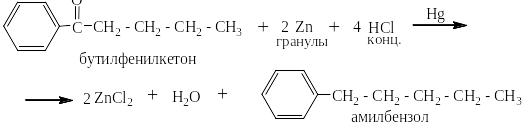
Или в две стадии по Кижнеру:

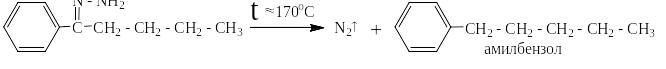
В тех (кстати многочисленных) случаях, когда для ацилирования используются ангидриды кислот реакции выглядят следующим образом:
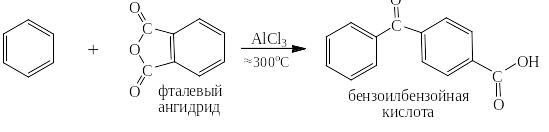
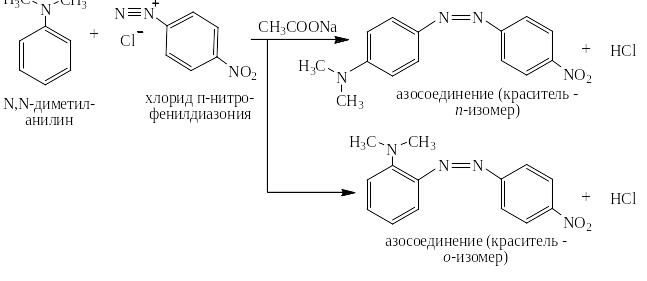
Реакция азосочетания с самим бензолом не проходит, но очень легко идёт с производными бензола, содержащими электронодонорные заместители такие как, например, гидроксильные группы – ОН или диалкиламиногруппы – NR2:
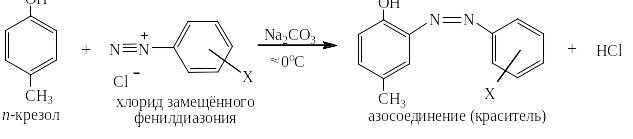
Сода поддерживает слабощелочную среду, связывая выделяющуюся сильную кислоту в соль:
![]()
Следует отметить, что в реакции азосочетания не требуется катализатор, так как любая соль диазония уже содержит катион, то есть атакующую частицу – А+. Заместитель Х может находиться в любом положении бензольного ядра соли диазония и сильно влияет на скорость реакции азосочетания и цвет красителя.
Реакции солей диазония с третичными жирно-ароматическими аминами наиболее быстро протекают в слабокислой среде, которую обеспечивает смесь ацетата натрия и образующейся из него уксусной кислоты:
![]()
