
- •Физические свойства бензола.
- •Способы получения бензола
- •Химические свойства бензола.
- •Реакции электрофильного замещения в бензоле
- •Влияние заместителей на скорость и направление реакций электрофильного и нуклеофильного замещения в бензольном ряду
- •Электроноакцепторные заместители
- •Нуклеофильное замещение атомов галогенов в бензольном ядре
- •Реакции активированного нуклеофильного замещения с аммиаком и аминами
- •Электронодонорные заместители
- •Пространственное влияние на направление химической реакции
- •Согласованное и несогласованное влияние заместителей
- •Особая группа заместителей
- •Наиболее важные производные ароматических углеводородов
- •Способы получения фенола и его аналогов
- •Электронное и пространственное строение фенола.
- •Химические свойства фенолов
- •Ароматические амины
- •Алкилирование натрового производного ацетанилида галогенпроизводными алканов:
- •Гидролиз n-алкильного производного ацетанилида
- •Содержание
Электронодонорные заместители
Общим признаком большинства электронодонорных заместителей является наличие неподелённой пары электронов на атоме, контактирующем с бензольным ядром, или принадлежность заместителя к алкилам.
Ниже приведены наиболее часто встречающиеся ЭД-заместители:
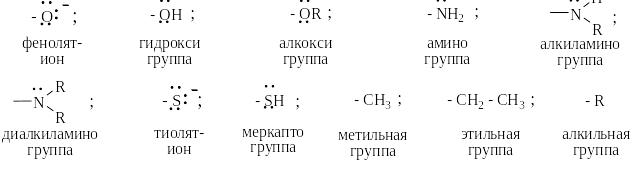
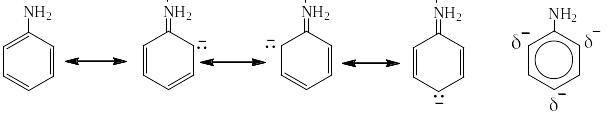
Влияние ЭД-заместителей можно легко объяснить с помощью написания резонансных структур Лайнуса Полинга. Например, для фенолят-иона:

Суперпозиция этих резонансных структур (то есть их мысленное наложение друг на друга) даёт резонансный гибрид, в котором в о- и п-положении находится частичный отрицательный заряд:

На представленной выше схеме видно, что частицы А+, которые должны были пролететь мимо, притягиваются ближайшим атомом углерода, находящимся в о- или п-положении. Это чрезвычайно сильно увеличивает вероятность удачных столкновений (кривые a,b,c,d). Частицы летящие прямо в м-положение попадут в него, так как δ-заряды, находящиеся на равном расстоянии лишь увеличат скорость соударения. Именно поэтому селективность реакций электрофильного замещения по о- и п-положениям составляет 95 – 97%, то есть всегда получается от 3 до 5% м-изомера по отношению к ЭД-заместителю.
Для незаряженных заместителей резонансные структуры биполярны, но в о- и п-положении резонансного гибрида так же находятся частичные отрицательные заряды.
Поэтому закономерности течения реакций электрофильного замещения для производных бензола с этими заместителями те же.
Во сколько раз ЭД-заместители ускоряют реакции этого типа оценим, сравнивая экспериментальные данные для бромирования бензола и фенола в щелочной среде:

Если считать, что мгновенно это одна секунда, что коэффициент Вант-Гоффа равен трём и, наконец, учитывая, что реакция идёт сразу в три положения, получим:
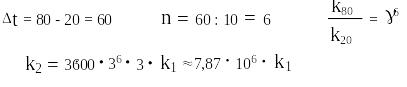
То есть ЭД-заместитель увеличивает скорость реакции в миллионы раз. Впрочем, если проводить реакцию в кислой среде, когда фенолят-ионов практически нет, то бромирование идёт намного медленнее и не в три положения сразу, а в о- и п-положения:
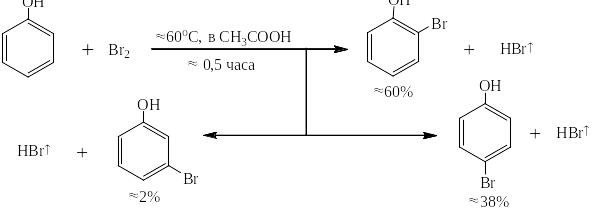
Следует отметить также, что если размеры заместителя и атакующего катиона не слишком велики, то о-изомера получается всегда больше, чем пара, так как о-положений два, а пара одно. Наличием 2 – 5 % м-изомера очень часто при записи реакций электрофильного замещения в производных бензола с ЭД-заместителями пренебрегают:
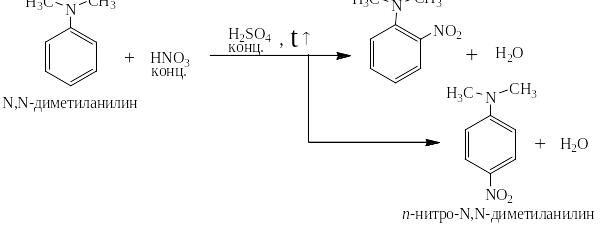
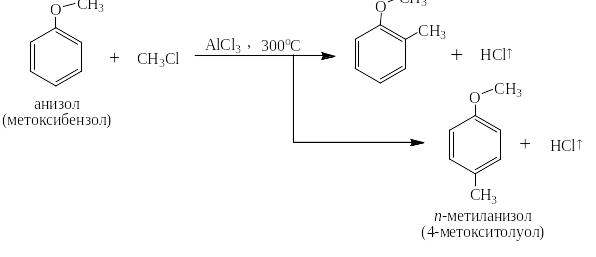
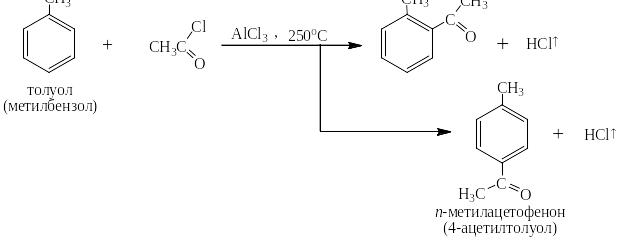
При описании крупных промышленных процессов, таких, например, как метилирование толула с целью получения смеси изомерных ксилолов, нужных для повышения октановых чисел бензинов, пренебрегать наличием м-изомера нельзя: наряду с миллионами тонн о- и п- изомеров получаются сотни тысяч тонн м-ксилолов:
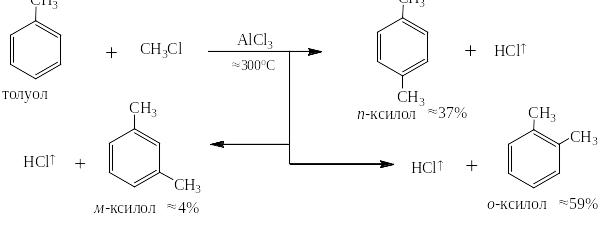
Пространственное влияние на направление химической реакции
Если размеры заместителя и атакующего катиона велики, то заместитель может препятствовать атаке в о-положение и соотношение о- и п-изомеров изменяется в пользу «неприкрытого» п-положения. Приведённые ниже примеры иллюстрируют такое пространственное влияние (или стерический фактор): при сульфировании толуола, в котором ЭД-заместитель – метил – самый маленький из всех алкилов лишь немного отклоняет распределение о- и п-изомеров от 66,7 : 33,3 %, что следует из теории вероятности:
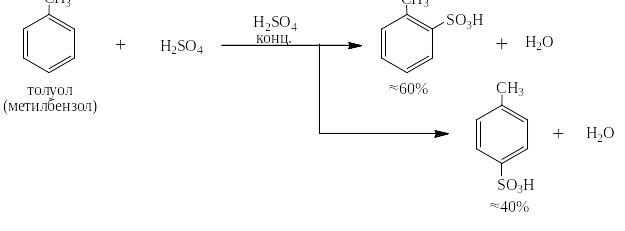
Гораздо больше отклонение от вероятностного в случае изопропильного заместителя; только 10%-ам объёмистых сульфониевых катионов удаётся попасть в о-положение к большому изопропилу:
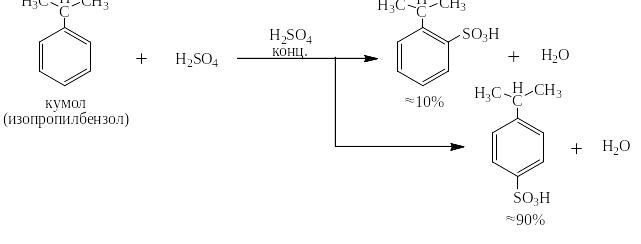
Если же заместителем является трет-бутил, то на 100% получается п-трет-бутилбензолсульфокислота:
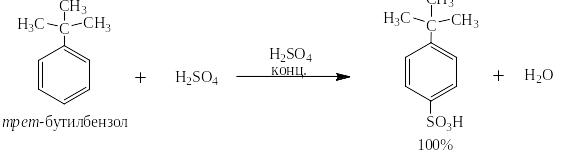
Когда атакующий катион меньше по своим размерам, например, катион нитрония или катион хлора, заметное количество о-изомера получается даже при наличии трет-бутильного заместителя:
