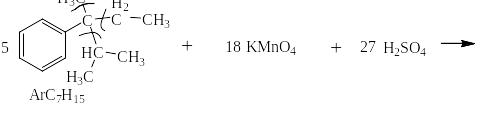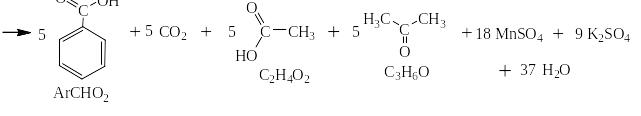- •Физические свойства бензола.
- •Способы получения бензола
- •Химические свойства бензола.
- •Реакции электрофильного замещения в бензоле
- •Влияние заместителей на скорость и направление реакций электрофильного и нуклеофильного замещения в бензольном ряду
- •Электроноакцепторные заместители
- •Нуклеофильное замещение атомов галогенов в бензольном ядре
- •Реакции активированного нуклеофильного замещения с аммиаком и аминами
- •Электронодонорные заместители
- •Пространственное влияние на направление химической реакции
- •Согласованное и несогласованное влияние заместителей
- •Особая группа заместителей
- •Наиболее важные производные ароматических углеводородов
- •Способы получения фенола и его аналогов
- •Электронное и пространственное строение фенола.
- •Химические свойства фенолов
- •Ароматические амины
- •Алкилирование натрового производного ацетанилида галогенпроизводными алканов:
- •Гидролиз n-алкильного производного ацетанилида
- •Содержание
АРЕНЫ или ароматические соединения
Понятие об ароматичности. Ароматическими называются циклические соединения, все атомы цикла которых находятся в состоянии sp2-гибридизации, циклическая часть молекулы которых является плоской, а число р-электронов, отдаваемое на образование единого π-облака, подчиняется правилу Хюккеля.
Правило Хюккеля: если число р-электронов, отдаваемое атомами на образование единого π-облака, приравнять к выражению 4 n + 2 и найти из получившегося уравнения n, то соединение будет ароматическим, если n – любое целое число, а если n – дробь, то соединение будет носить характер непредельного.
Самым старым и самым надёжным экспериментальным критерием ароматичности химического соединения является его склонность к реакциям замещения в отличие от непредельных соединений, которые склонны к реакциям присоединения, хотя и те и другие содержат атомы в состоянии sp2-гибридизации и в принципе должны что-то присоединить, чтобы перейти в состояние sp3-гибридизации. Например, алкен – непредельное соединение даже на морозе в органическом растворителе быстро присоединяет бром:

Тогда как бензол – ароматическое соединение реагирует с бромом только при нагревании, в присутствии катализатора – FeBr3 и путём замещения – выделяется HBr:
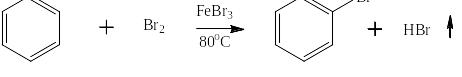
Очень полезную информацию об ароматичности или непредельности циклических соединений дают физические методы исследования: рентгеноструктурный анализ и анализ спектров ядерного магнитного резонанса (далее ЯМР). Рентгеноструктурный анализ с высокой точностью показывает положение всех ядер молекулы исследуемого соединения. Если все ядра цикла лежат в одной плоскости, то получен хороший аргумент в пользу ароматичности, а, если часть ядер выходит из плоскости, выбранной по положению любых трёх ядер, то молекула в соответствии с приведённым выше определением ароматической точно быть не может. Например, у бензола, нафталина и азулена
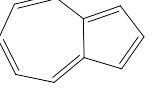
молекулы плоские и они действительно ароматические соединения, тогда как 1,3,5,7-циклооктатетраен,
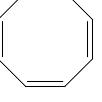
все атомы углерода которого находятся также как и у приведённых выше соединений в состоянии sp2-гибридизации, молекула не плоская, а имеет форму «ванны»
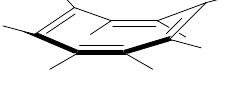
или
«кресла», соединение непредельное –
очень легко
 присоединяет
при комнатной температуре четыре моля
брома:
присоединяет
при комнатной температуре четыре моля
брома:
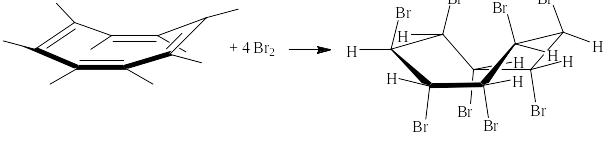
В спектрах ЯМР каждому «сорту» протонов на графике зависимости «интенсивность сигнала от химических сдвигов – δ » соответствует своё положение на оси абсцисс. Например, если принять для тетраметилсилана (ТМС) – Si(CH3)4 величину δ равной нулю, то у циклогексана (Цгс) -- С6Н12 она будет равна 1,41 , у ацетона (Ацн) – СН3-СО-СН3 - 2,09 , у хлороформа (Хлф) – CHCl3 – 7,33 и у бензола (Бзл) – С6Н6 -- 7,17. Интенсивность пиков зависит от числа одинаковых протонов. Следует отметить, что в каждом из перечисленных соединений все протоны химически эквивалентны. Поэтому интенсивность пиков у тетраметилсилана и циклогексана (у них по 12 протонов) самая высокая, у ацетона и бензола примерно вдвое ниже (по 6 протонов) и у хлороформа, имеющего лишь один протон, самая низкая. Упрощённо спектр ЯМР для этих веществ выглядит так:
Рост величины δ называется сдвигом в слабое поле. Сама величина определяется по формуле:
δ = (Нобр - Нэтал)●106/ Но,
где Но – напряжённость магнитного поля, создаваемая прибором, Нэтал - напряжённость вторичного магнитного поля, связанная с электронным окружением ядер атомов водорода эталонного вещества, например ТМС, а Нобр – то же для, образца исследуемого соединения.
Если в соединении имеются протоны «разного сорта», то в спектре ЯМР будут наблюдаться пики различной интенсивности для каждого из них. Например, в спектре
циклопентадиена
 три
пика.
три
пика.
Однако, если отнять от него протон, оставив два электрона, то образуется циклопентадиенильный анион, в котором на пять ядер атомов углерода имеется шесть p-электронов:
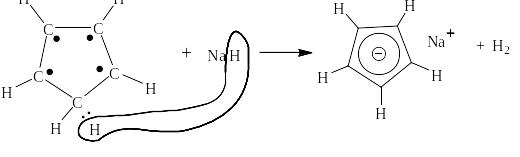
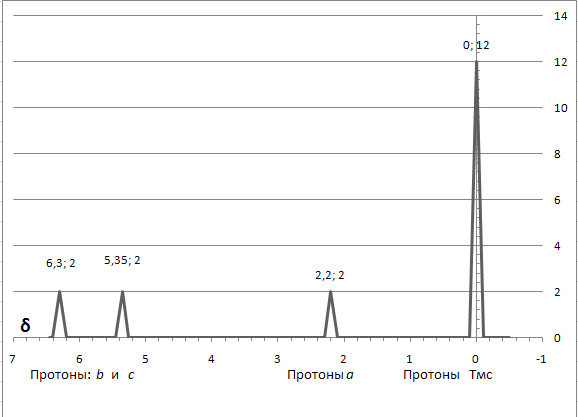
Ниже приведены спектры ЯМР циклопентадиена и получающегося из него аниона, который по правилу Хюккеля должен быть ароматичным, так как из уравнения 6 = 4n + 2 величина n равна 1, то есть целому числу.
СПЕКТР ЯМР ЦИКЛОПЕНТАДИЕНА
СПЕКТР ЯМР ЦИКЛОПЕНТАДИЕНИДНОГО АНИОНА
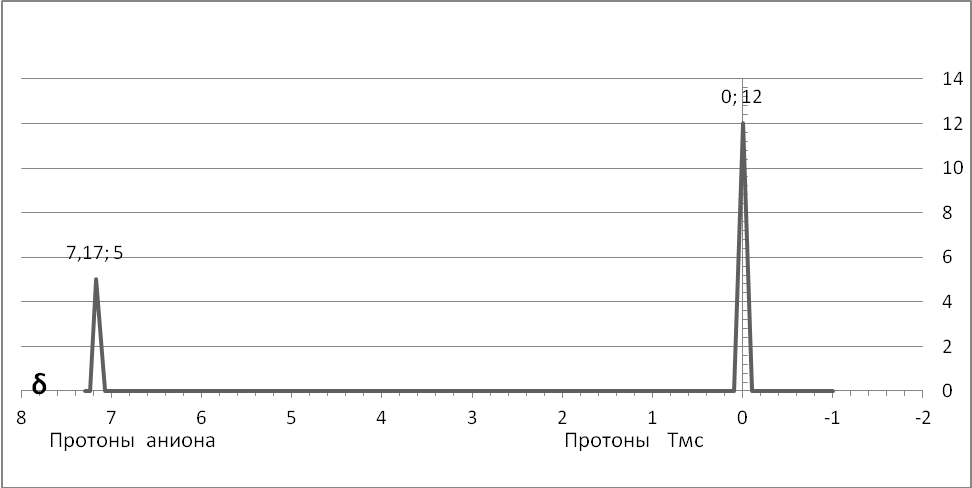
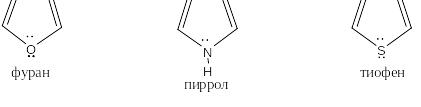
При сравнении спектров хорошо видно, что вместо трёх пиков у циклопентадиена у аниона наблюдается только один пик большей интенсивности. Протоны в анионе стали эквивалентными. Это веский аргумент в пользу ароматичности циклопентадиенильного иона. Молекулы и ионы, в которых на пять ядер приходится шесть р-электронов, образующих единое π-облако, называются . В качестве примеров таких систем можно привести молекулы фурана, пиррола и тиофена. Каждый из атомов углерода в них отдаёт на образование единого π-облака по одному р-электрону, а каждый из гетероатомов, то есть: кислород, азот или сера выводит на р-орбиталь свою неподелённую пару электронов (азот) или только одну из таких пар (кислород и сера)
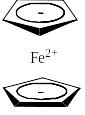
Очень интересным является соединение с брутто-формулой (C5H5)2Fe – ферроцен. Между двумя плоскими циклопентадиенильными анионами, лежащими в параллельных плоскостях, находится двухзарядный катион железа:
 Ниже
представлен ЯМР спектр циклогептатриена,
у которого один из атомов цикла
находится в состоянии sp3-гибридизации,
в связи с чем он не может быть ароматическим
соединением, а является веществом
непредельным. Действительно он легко
при комнатной температуре присоединяет
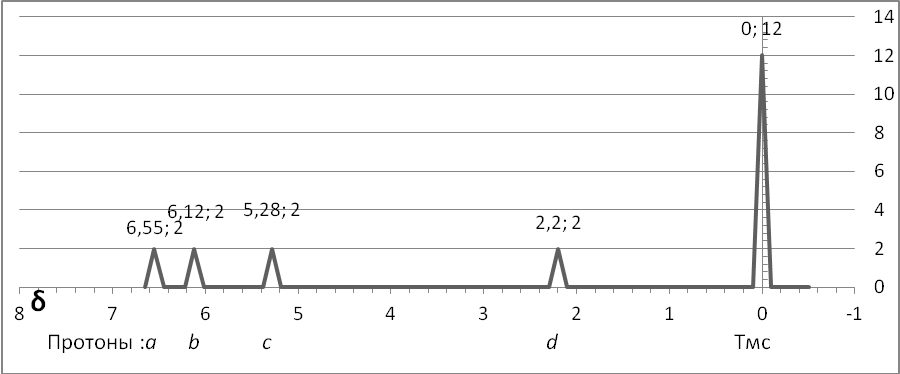
три моля брома. В спектре ЯМР хорошо
видны сигналы четырёх сортов протонов:
a,b
и c
– протоны при атомах углерода в состоянии
sp2-гибридизации
и d при атоме углерода в состоянии
sp3-
гибридизации.
Ниже
представлен ЯМР спектр циклогептатриена,
у которого один из атомов цикла
находится в состоянии sp3-гибридизации,
в связи с чем он не может быть ароматическим
соединением, а является веществом
непредельным. Действительно он легко
при комнатной температуре присоединяет
три моля брома. В спектре ЯМР хорошо
видны сигналы четырёх сортов протонов:
a,b
и c
– протоны при атомах углерода в состоянии
sp2-гибридизации
и d при атоме углерода в состоянии
sp3-
гибридизации.
СПЕКТР ЯМР ЦИКЛОГЕПТАТРИЕНА
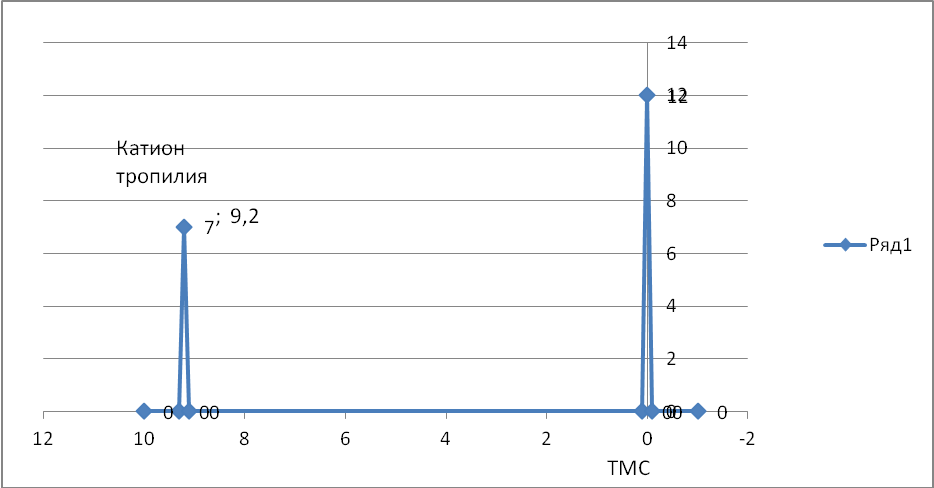
Если от циклогептатриена отнять атом водорода с парой электронов ( то есть отнять гидрид-ион), то образуется ароматический катион, котором на семь ядер приходится шесть р-электронов. Такие соединения называются π-недостаточными системами. Ниже представлена реакция циклогептатриена с перхлоратом трифенилметильного катиона, который является акцептором гидрид-иона и превращается при его присоединении в трифенилметан. Циклогептатриен после отщепления гидрид-иона становится катионом, который называется катионом тропилия.
Ниже схемы реакции приведён его спектр ЯМР. Видно, что все семь протонов стали идентичными – дают всего один сигнал большой интенсивности в слабом поле.
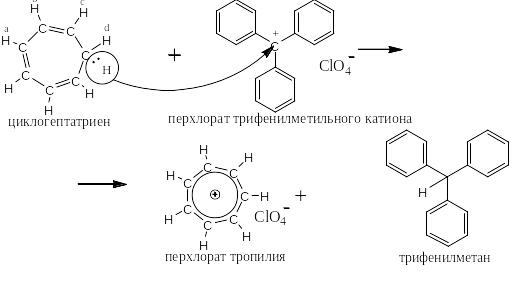
СПЕКТР ЯМР КАТИОНА ТРОПИЛИЯ
Интересно, что природное соединение – азулен, которое встречается в эфирных маслах растений, является комбинацией пятичленного и семичленного циклов, в связи с чем на первом из них сосредотачивается частичный отрицательный, а на втором частичный положительный заряд. Не удивительно, поэтому, что азулен имеет заметный
дипольный
момент – около 1 Дебая. Для сравнения
дипольные моменты бензола и нафталина
равны 0, а дипольные моменты несимметричных
соединений с ковалентными полярными
связями имеют величины большие нуля,
например, СН3Вr
– 1,8 D,
угловая молекула диметилового эфира
![]() - 1,3 D, а молекула
ацетона
- 1,3 D, а молекула
ацетона
![]()
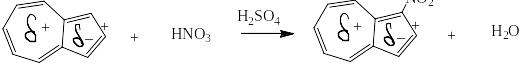
- 2,7 D. Не удивительно также и то, что азулен окрашен в сине-фиолетовый цвет и что он легко вступает в реакции электрофильного замещения, такие как сульфирование, нитрование, ацилирование и галогенирование, причём исключительно путём замещения атомов водорода в пятичленном отрицательно заряженном цикле, например:
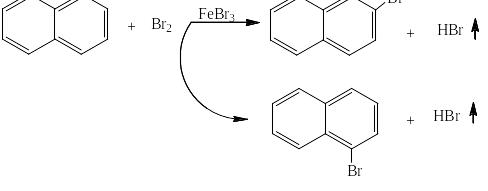
Нафталин – соединение, содержащее формально пять двойных связей и, следовательно, 10 р-электронов, согласно правилу Хюккеля должен быть ароматичным, так как из уравнения 10 = 4n + 2 получается, что n = 2, то есть целое число. И действительно нафталин склонен к реакциям электрофильного замещения, таким как сульфирование, нитрование, ацилирование или приведённое ниже в качестве примера бромирование:
Напротив, такие внешне похожие на арены соединения, как пирен и коронен, у которых число n соответственно равно 3,5 и 5,5 (то есть дроби) оказываются непредельными и реагируют с бромом как показано ниже:
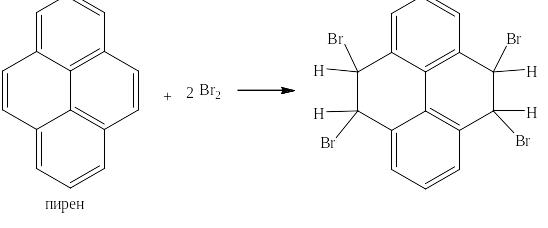

Видно, что после присоединения соответственно двух или трёх молей брома на моль пирена или коронена остаются чрезвычайно термодинамически выгодные бензольные кольца, которые с бромом без катализатора и повышения температуры не реагируют.
Бензол
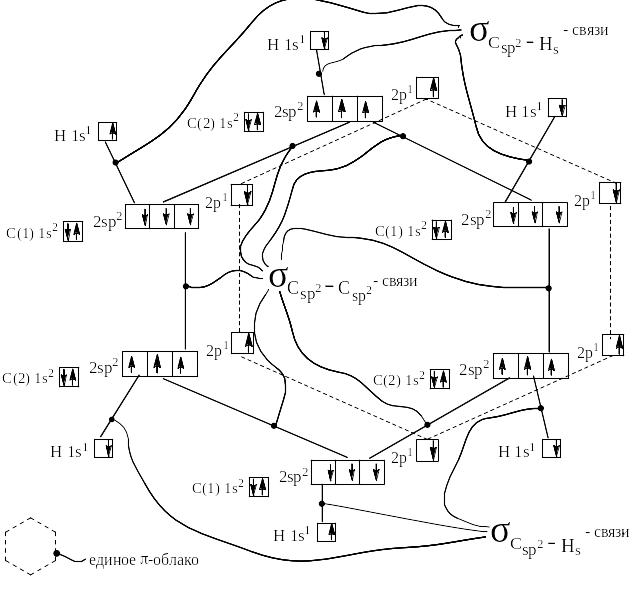
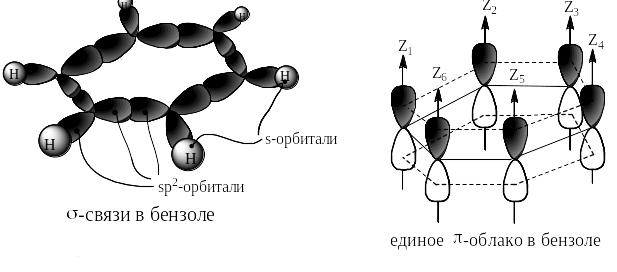
Бензол открыт в 1825 г Майклом Фарадеем. Брутто-формула бензола С6Н6. Электронное и пространственное строение представлено на следующей странице. Ядра всех атомов углерода и водорода находятся в одной плоскости. Длины всех связей С – С одинаковы и равны 1,41 Å. Все шесть p-орбиталей перекрываются над и под плоскостью, проходящей через ядра атомов, и образуют единое π-облако. Оси σ-связей лежат в той же плоскости и направлены по отношению друг к другу под углами 120О.
Физические свойства бензола.
Бензол
– бесцветная жидкость. Имеет три
максимума поглощения в ультрафиолетовой
части спектра: при 183 нм (ε = 46000), при 203
нм (ε = 7400) и 255 нм (ε = 220). tкип.=
80,1OC
при 760 мм.рт. ст. Плотность ρ = 0,879 г/мл.
вязкость μ = 0,6487 спуаз. Дизлектрическая
проницаемость ε = 2,28 (при 20ОС).
Растворимость в воде ![]() =
0,18 г/100 г.
Бензол
смешивается в любых соотношениях с
жидкими алканами, их смесями (бензин,
керосин, уайт-спирит, петролейный эфир),
простыми эфирами, скипидаром. С метанолом
даёт расслаивающуюся систему: два
раствора: верхний слой – раствор бензола
в метаноле и нижний – раствор метанола
в
бензоле.
Бензол практически нерастворим в
этиленгликоле и глицерине. Сам бензол
растворяет очень многие органические
вещества, например, нитробензол, анилин,
фенол, многие лекарственные препараты.
Из простых веществ он растворяет йод,
серу, белый фосфор. Из неорганических
веществ, например, трихлорид азота
(NCl3),
гидроксиламин (NH2-OH),
хлорид алюминия (AlCl3)
и йодид индия (InI3).
Из комплексных соединений
растворяет,
например, пентакарбонилжелезо [Fe(CO)5]
и
тетракарбонилникель [Ni(CO)4].
=
0,18 г/100 г.
Бензол
смешивается в любых соотношениях с
жидкими алканами, их смесями (бензин,
керосин, уайт-спирит, петролейный эфир),
простыми эфирами, скипидаром. С метанолом
даёт расслаивающуюся систему: два
раствора: верхний слой – раствор бензола
в метаноле и нижний – раствор метанола
в
бензоле.
Бензол практически нерастворим в
этиленгликоле и глицерине. Сам бензол
растворяет очень многие органические
вещества, например, нитробензол, анилин,
фенол, многие лекарственные препараты.
Из простых веществ он растворяет йод,
серу, белый фосфор. Из неорганических
веществ, например, трихлорид азота
(NCl3),
гидроксиламин (NH2-OH),
хлорид алюминия (AlCl3)
и йодид индия (InI3).
Из комплексных соединений
растворяет,
например, пентакарбонилжелезо [Fe(CO)5]
и
тетракарбонилникель [Ni(CO)4].
Электронное и пространственное строение бензола.
Способы получения бензола
В 1868 году французский химик Пьер Эжен Марселен Бертло открыл реакцию получения бензола тримеризацией ацетилена. Выход бензола был очень низким, но Бертло не стал улучшать технологию. Зато этой реакцией заинтересовался Николай Дмитриевич Зелинский, который уже тогда серьёзно занимался катализом. В результате работ проведённых с учеником – Б.А. Казанским был подобран катализатор – активированный уголь и установлен оптимальный температурный режим:
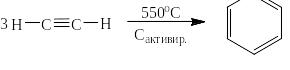
В 1943 году реакцию тримеризации очень существенно модифицировал немецкий химик Вальтер Юлиус Реппе, применив в качестве катализатора комплексное соединение никеля с карбонильными лигандами и трифенилфосфином. Реакция проходит при относительно низких температурах со 100% выходом:
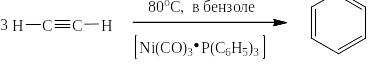
В 1911 году Н.Д. Зелинским и Н.Л. Глинкой был предложен способ получения бензола путём каталитического диспропорционирования циклогексена на циклогексан и бензол:
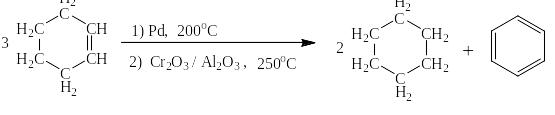
То же для циклогексадиена:
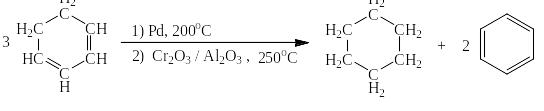
Бензол может быть получен также путём каталитического дегидририрования циклогексана при пониженном давлении:
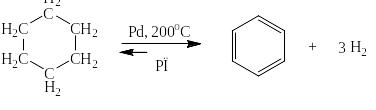
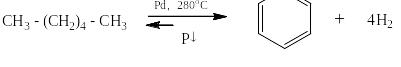
Или гексана при более высокой температуре:
Из бензолкарбоновых кислот бензол может быть получен в две стадии: первая – получение натровой соли:
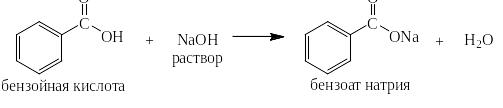
и вторая – нагревание сухой натровой соли с сухой щёлочью:
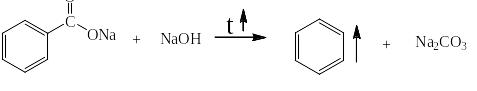
Аналогично для олигокарбоновых кислот:

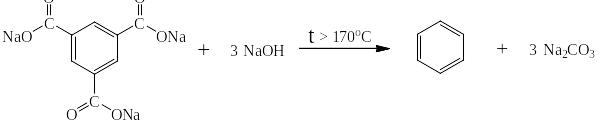
Химические свойства бензола.
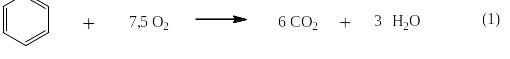
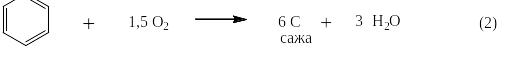
Окисление бензола. Бензол летуч и его пары легко воспламеняются на воздухе. При хорошем смешивании с избытком воздуха (более 7,5 моль О2 на 1 моль бензола) происходит сгорание по уравнению (1),а при недостатке кислорода по уравнению (2):
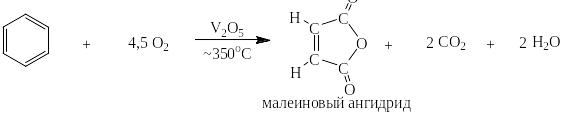
Каталитически, при строго контролируемом расходе воздуха (4,5 моль О2 на 1 моль бензола) бензол может быть окислен до малеинового ангидрида:
Ещё легче окисляется до фталевого ангидрида нафталин:
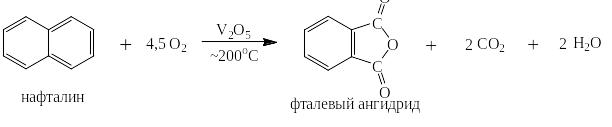
Оба ангидрида имеют большое практическое значение для синтеза красителей, пластификаторов, лекарственных препаратов, полиэфирных и алкидных смол, пестицидов, присадок к смазочным маслам и ПАВ. Объём производства малеинового ангидрида составляет только в США около 150000 т/год.
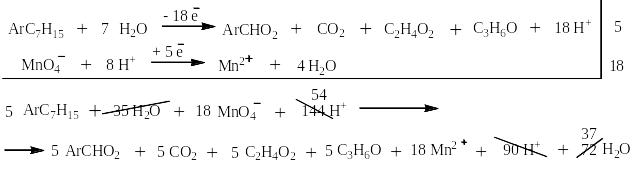
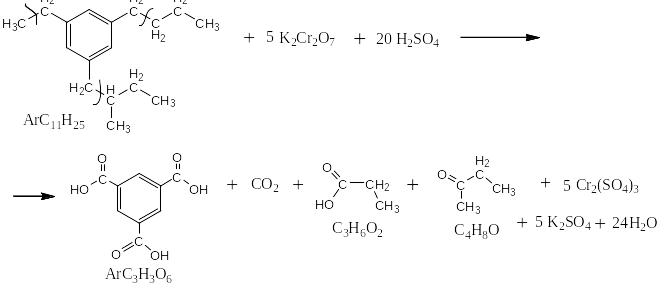
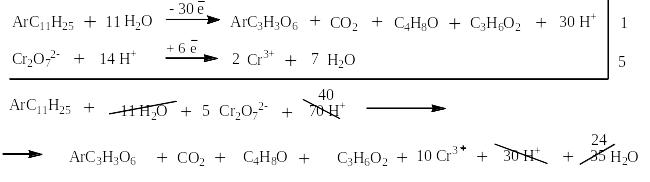
Сильными окислителями (KMnO4, K2Cr2O7, NaBiO3) в жидкой фазе в кислой среде сам бензол не окисляется. Зато его алкильные производные окисляются очень легко. При этом получается бензойная кислота или олигокарбоновые кислоты и в зависимости от строения алкильного производного углекислый газ, алифатические карбоновые кислоты и алифатические кетоны. На следующей странице представлена схема, на основании которой легко могут быть написаны как органические, так и неорганические конечные продукты окисления.
Схема окисления алкильных производных бензола
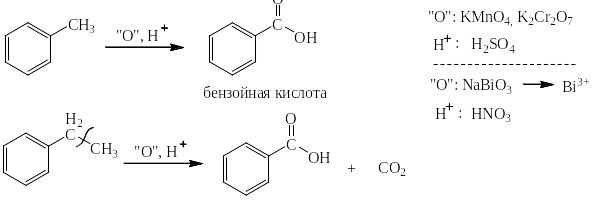
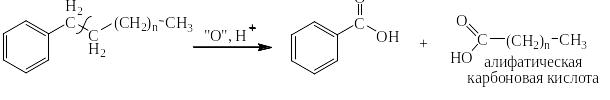
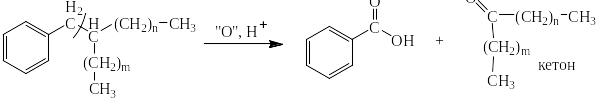
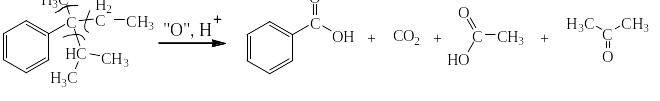
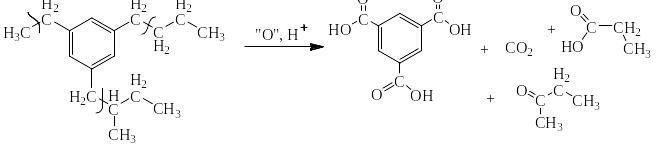
Ниже приведены примеры реакций окисления алкильных производных бензола перманганатом калия и дихроматом калия в сернокислой среде: