
- •Физические свойства бензола.
- •Способы получения бензола
- •Химические свойства бензола.
- •Реакции электрофильного замещения в бензоле
- •Влияние заместителей на скорость и направление реакций электрофильного и нуклеофильного замещения в бензольном ряду
- •Электроноакцепторные заместители
- •Нуклеофильное замещение атомов галогенов в бензольном ядре
- •Реакции активированного нуклеофильного замещения с аммиаком и аминами
- •Электронодонорные заместители
- •Пространственное влияние на направление химической реакции
- •Согласованное и несогласованное влияние заместителей
- •Особая группа заместителей
- •Наиболее важные производные ароматических углеводородов
- •Способы получения фенола и его аналогов
- •Электронное и пространственное строение фенола.
- •Химические свойства фенолов
- •Ароматические амины
- •Алкилирование натрового производного ацетанилида галогенпроизводными алканов:
- •Гидролиз n-алкильного производного ацетанилида
- •Содержание
Согласованное и несогласованное влияние заместителей
Если заместителей в молекуле ароматического соединения два или более, то они могут влиять на направление реакций электрофильного замещения либо согласованно, либо несогласованно. Например, в п-нитротолуле метил – ЭД-заместитель и ориентирует вступающий электрофильный реагент в о- и п-положения по отношению к себе, аа нитрогруппа ЭА- заместитель и ориентирует этот же реагент в м-положение по отношению к себе. В этом случае влияние согласованное и, например, при бромировании получается лишь один конечный продукт:
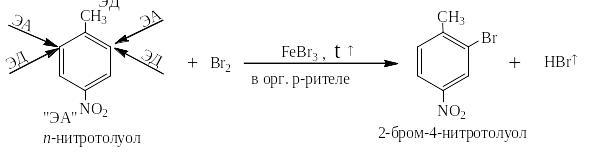
Напротив в м-нитротолуоле наблюдается несогласованное влияние заместителей и получаются четыре изомера, причём тех изомеров, которые образуются в соответствии с влияющим действием ЭД-заместителя получается много, а ЭА- заместителя – мало:
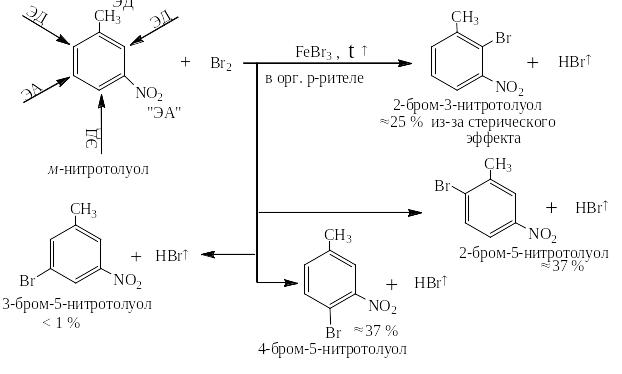
Снижение выхода 2-бром-3-нитротолуола по сравнению с выходами 2- и 4- бром-5-нитротолуолов объясняется пространственными трудностями попадания катиона брома между метильной и нитрогруппами.
Особая группа заместителей
В особую группу заместителей (ОГ) выделяют такие, которые с одной стороны обладают неподелённой парой электронов на атоме, контактирующем с бензольным ядром (как ЭД- заместители), а с другой стороны имеют сильный индукционный эффект ( - I ), превышающий по абсолютной величине мезомерный эффект (+ М ) от сопряжения с упомянутой выше неподелённой парой электронов. К ОГ- заместителям, относятся, например, атомы галогенов и многочисленные ациламиногруппы:

Ниже с помощью резонансных структур показано на примере хлора мезомерное влияние ОГ-заместителя ( + М-эффект) :

Индуктивное и суммарное влияние, а так же атака электрофильным реагентом, выглядят следующим образом:
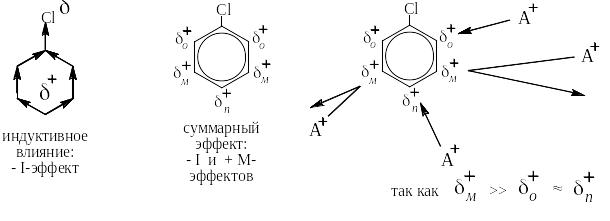
Таким образом ОГ-заместители затрудняют (но не так резко, как ЭА-заместители) реакции электрофильного замещения и ориентируют вступающий элетрофильный реагент в о- и п-положение по отношению к себе (как ЭД –заместители).
Ниже приведены примеры реакций электрофильного замещения в производных бензола с ОГ-заместителями:
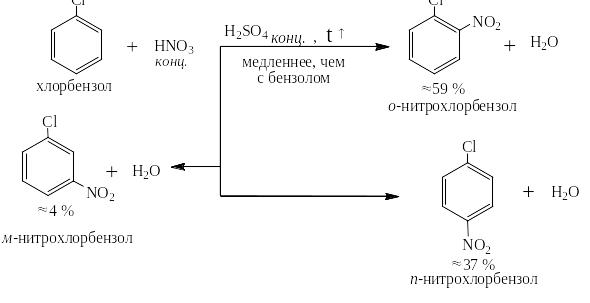
В случае N-ациламинопроизводных бензола скорость реакции суммарно в о- и п-положение очень мало отличается от скорости реакции с незамещённым бензолом, например:
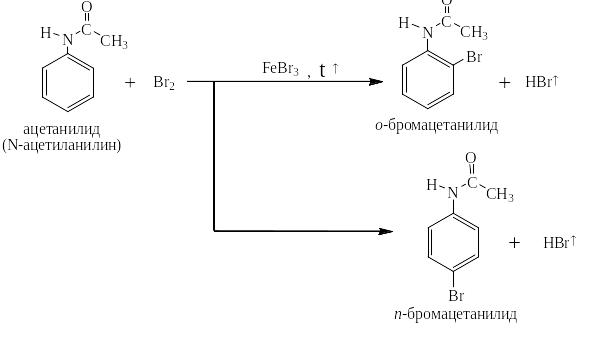
В том случае, когда в молекуле ароматического вещества находятся два заместителя (или более), один из которых ОГ возможно и согласованное, и несогласованное их действие, например:
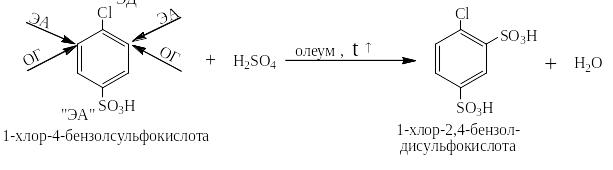

Наиболее важные производные ароматических углеводородов
В этом разделе будут рассмотрены способы получения, физические и химические свойства фенолов, ароматических и жирноароматических аминов и некоторых их производных, а так же карбоновых и сульфокислот ароматического ряда.
Фенолы
Фенолами называются производные ароматических углеводородов, содержащие гидроксильную группу (ОН) непосредственно связанную с одним из атомов углерода ароматического цикла, например:
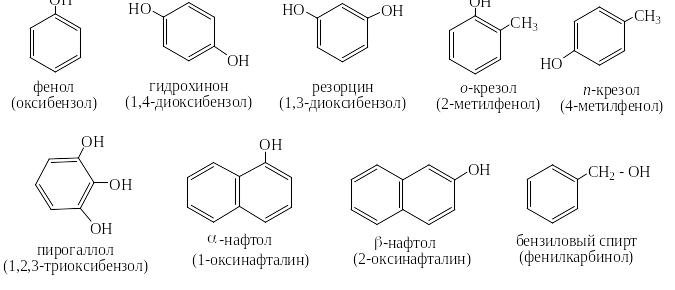
Следует отметить, что приведённый последним бензиловый спирт не является фенолом, так как гидроксильная группа в нём отделена от атома углерода цикла метильной группой. Его кислотность, например, во много раз ниже чем у фенола и изомерных ему крезолов: рКа фенола, п-крезола и бензилового спирта соответственно: 10,00 ; 10,26 и ≈ 16. То есть фенолы примерно в миллион (!!!) раз более сильные кислоты, чем спирты.
Фенол
Электронное и пространственное строение фенола представлено на стр.39. Видно, что одна из неподелённых пар электронов атома кислорода выходит на р-орбиталь и и становится сопряжённой с единым π-облаком бензольного ядра. Другая неподелённая пара электронов остаётся на sp2-орбитали.
Фенол – твёрдое бесцветное вещество с температурой плавления 43ОС. На воздухе фенол быстро розовеет, потом становится фиолетовым в результате окисления с образованием интенсивно окрашенных продуктов. Перегонка такого окрашенного фенола обычно даёт более 99% бесцветного вещества. Кипит фенол при 182ОС.
В воде фенол хорошо растворим даже при температурах ниже комнатных. Так, например, при 15ОС его растворимость составляет 8,2 г / 100 г воды. С ростом температуры растворимость фенола быстро увеличивается и при 66ОС он уже смешивается с водой в любых соотношениях. Фенол хорошо растворим также в низших спиртах (метаноле, этаноле и обоих пропанолах), ацетоне, бензоле, сероуглероде и хлороформе. Будучи кислотой хорошо растворяется в щелочах, переходя при этом в соли – феноляты.
Фенол имеет характерный запах, знакомый многим по запаху при мытье полов в медицинских учреждениях, где он (карболовая кислота) используется, как антисептик.
