
- •Контрольное задание I
- •1. Энергетика химических процессов. Термохимические расчеты
- •Контрольные задания
- •2. Химическое сродство. Направленность химических реакций
- •Контрольные задания
- •3. Химическая кинетика и химическое равновесие
- •3.1. Понятие о скорости химической реакции
- •3.3. Влияние температуры на скорость химической реакции
- •3.4. Химическое равновесие
- •3.5. Смещение химического равновесия
- •Контрольные задания
- •4. Электронные структуры атомов и периодическая система элементов
- •4.1. Электронные формулы атомов. Ковалентность атомов
- •Контрольные задания
- •5. Периодическое изменение свойств элементов
- •Контрольные задания
- •6. Химическая связь. Строение молекулы
- •6.1. Основные характеристики химической связи – длина связи, энергия связи
- •6.2. Типы химической связи и квантово-механическое объяснение ковалентной связи. Строение молекул
- •6.2.1. Определение типа химической связи по разности электроотрицательностей атомов, образующих связь
- •6.2.2. Нахождение электрического момента диполя связи и молекулы
- •6.2.3. Объяснение строения молекул по методу валентных связей (вс)
- •6.2.4. Определение типа гибридизации атомных орбиталей пространственной конфигурации молекулы по методу вс
- •6.2.5. Объяснение образования и свойств двухатомных молекул типа в2 по методу молекулярных орбиталей (мо)
- •Контрольные задания
- •7. Способы выражения количественного состава растворов
- •7.1. Массовая доля, титр, моляльная и молярная концентрации
- •7.2. Эквивалент, фактор эквивалентности, молярная концентрация эквивалентов
- •Контрольные задания
- •8. Ионно-обменные реакции
- •Контрольные задания
- •9. Гидролиз солей
- •Контрольные задания
- •10. Окислительно-восстановительные реакции
- •Степень окисления (со) атомов некоторых элементов
- •Контрольные задания
- •11. Гальванические элементы и эдс
- •Контрольные задания
- •12. Коррозия и защита металлов
- •Контрольные задания
- •13. Электролиз
- •Контрольные задания
- •14. Жёсткость воды и методы её устранения
- •Контрольные задания
- •Библиографический список
- •Оглавление
- •Длина связи (d)
- •Энергия связи (h)
- •Электрические моменты диполей молекул (дипольный момент)
- •Константы диссоциации некоторых электролитов в водных растворах при 25 оС
- •Растворимость кислот, оснований и солей в воде
- •Произведение растворимости некоторых малорастворимых электролитов
- •Стандартные электродные потенциалы
- •Потенциалы водородного и кислородного электродов
- •Перенапряжение выделения водорода н2 и кислорода о2
- •Стандартные электродные потенциалы некоторых окислительно-восстановительных и газовых
6.2. Типы химической связи и квантово-механическое объяснение ковалентной связи. Строение молекул
6.2.1. Определение типа химической связи по разности электроотрицательностей атомов, образующих связь
Образование различных типов химической связи зависит от способности атомов отдавать или притягивать электроны. Такая способность характеризуется величиной электроотрицательности (ЭО). Чем больше величина ЭО. тем больше способность атомов притягивать электроны. Если разность ЭО (Δ ЭО) между двумя атомами, образующими связь равна нулю (Δ ЭО = 0), то такая связь неполярная ковалентная. При 0 < Δ ЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2.
Пример 3. Определите, какой тип связи а соединениях КС1, Н2, SO2.
Решение: Пользуясь величинами ЭО для каждого атома (приложение, табл. П4), находим Δ ЭО.
Атомы |
K–Cl |
H–H |
S–O |
ЭО |
0,8 3,0 |
2,1 2,1 |
2,5 3,5 |
ΔЭО |
2,2 |
0 |
1,0 |
На основании полученных данных Δ ЭО делаем вывод, что связь К–С1 ионная (ΔЭО > 2), связь Н–Н неполярная ковалентная (Δ ЭО = 0) и связь S–O полярная ковалентная (0 < ΔЭО < 2).
Пример 4: Определите, в каких молекулах (CCl4, NaH, H2S) полярность наибольшая.
Решение: Находим значение ЭО для каждого атома (приложение, табл. П4) и определяем ΔЭО для каждой пары атомов, образующих химическую связь в молекулах.
Атомы |
C–Cl |
Na–H |
H–S |
ЭО |
2,5 3,0 |
0,9 2,1 |
2,1 2,5 |
ΔЭО |
0,5 |
1,2 |
0,4 |
Наиболее полярной является связь Na–H, так как в этом случае величина ΔЭО – самая наибольшая.
6.2.2. Нахождение электрического момента диполя связи и молекулы
Дня оценки полярности связи и молекулы используют электрический момент диполя μ, равный произведению длины диполя на электрический заряд q (q = 1,602 · 10-19 Кл), т.е. μ = 1q. Для полярных связей и молекул μ > 0, для неполярных μ = 0. Электрический момент диполя – система двух равных и противоположных по знаку электрических зарядов – есть векторная величина, направленная от положительного к отрицательному заряду. Единица измерения μ – Дебай (D): D=3,33 · 10-30 Kл · м. Электрический момент диполя двухатомной молекулы равен электрическому моменту диполя связи. Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов диполей всех связей.
Пример 5. Определите электрический момент диполя молекулы HF и его направление, если μ связи равен 1,9D (приложение, табл. П5).
Решение: Молекула HF – двухатомная, имеет линейное строение: H–F. Следовательно, электрический момент диполя связи равен электрическому моменту диполя молекулы (1,91D) и направлен от водорода, имеющего положительный заряд, к отрицательному фтору: HF (ЭОН = 2,1; ЭОF = 4,0).
Пример 6. Молекула BeН2 имеет линейное строение. Валентный угол Н–Ве–Н составляет 180°. Связи Ве–Н полярны (ЭОВе = 1,5; ЭОH = 2,1). Молекула Н2О имеет угловое строение (валентный угол Н-О-Н равен 104°30'). Связи Н–О полярны (ЭОH = 2,1; ЭОO = 3,5). Будут ли обе молекулы полярные?
Решение:
В молекуле ВеН2
связи полярные и вектор электрического
момента диполя связи Ве–Н2
направлен от (+) к (–), т.е. от бериллия с
меньшей величиной ЭО к водороду с
большей величиной ЭО, а именно H![]() .
Векторная сумма электрических моментов
диполей связей, одинаковых по величине
и противоположных по знаку, равна нулю.
Следовательно, молекула неполярна (
.
Векторная сумма электрических моментов
диполей связей, одинаковых по величине
и противоположных по знаку, равна нулю.
Следовательно, молекула неполярна (![]() = 0).
= 0).
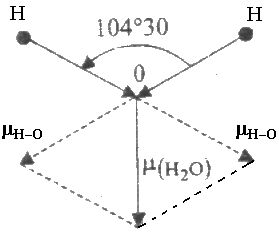
В молекуле Н2О полярные связи Н–О располагаются под углом 104°30' (рис. 1). Поэтому их электрические моменты диполей связей взаимно не
компенсируются
Результирующая сумма электрических
моментов диполей связей – не равна
нулю (μ
Пример
7.
Длина диполя молекулы равна 3,37 ·
10–19
м. Найдите электрический момент диполя
молекулы.
![]() > 0),
поэтому
молекула воды полярна.
> 0),
поэтому
молекула воды полярна.
Рис. 1. Электрический момент диполя
молекулы Н2О
Решение: Электрический заряд q = 1,602 · 10–19 Кл. Электрический момент диполя молекулы находим по формуле μ = 1 · q = 1,602 · 10–19 · 3,37 · 10–11 = = 5,4 · 10 -30 Кл · м. (1,63 D).
Ответ: 5,4 · 10–30 Кл·м. = (1,63 D).
