
- •Часть 1
- •Содержание
- •Глава 1. Общая характеристика и классификация свободных радикалов. Активированные кислородные метаболиты.
- •Характерные значения времен жизни и радиусов диффузии акм в биологических субстратах
- •Метаболизм свободных радикалов (Владимиров ю.А., 1998)
- •Биологические эффекты акм в живых системах
- •Контрольные вопросы
- •Глава 2. Характеристика активных форм кислорода, их биологическая роль (физиологические и патологические эффекты)
- •2.1. Синглетный кислород
- •Пути образования синглетного кислорода в биосистемах
- •Химические реакции 1о2.
- •Биологическое значение 1о2
- •2.2. Супероксидный анион-радикал
- •2. Окислительно-восстановительные процессы, катализируемые металлофлавопротеидами, а также электрон-транспортные цепи митохондрий и микросом
- •Биологическая роль ксантиноксидазы
- •2.2. Образование супероксидного анион-радикала в митохондриях
- •2.3. Образование супероксидного анион-радикала в микросомах
- •2.4. Образование супероксидного анион-радикала надфн-оксидазой
- •Структура надфн-оксидазы
- •Каталитический цикл надфн-оксидазы
- •Биологические эффекты о2..
- •2.3. Перекись водорода
- •Н2о2-сенсоры легких и кровеносных сосудов
- •2.4. Гидроксильный радикал
- •Биологические эффекты он-радикалов:
- •Глава 3. Характеристика гипогалогенитов и путей их образования
- •Биологическая роль мпо:
- •Контрольные вопросы
- •Глава 4. Оксид азота как регулятор клеточных функций
- •Двойственные функции no: посредник и токсин
- •Контрольные вопросы
- •Список литературы
2.2. Супероксидный анион-радикал
Присоединение одного электрона к молекуле кислорода в основном состоянии приводит к образованию супероксидного анион-радикала (О2. ):
О2 + е- → О2.
2рπ* |
|
Триплетное состояние О2 О2.
Схема электронного строения 2р-подуровня молекулы кислорода и супероксидного анион-радикала
При протонировании О2. переходит в гидроперекисный радикал (НО2.). О2. имеет заряд и поэтому плохо мигрирует через мембраны в отличие от НО2.. О2. более реакционноспособное соединение, чем молекулярный кислород. Время жизни О2._ - 10 -6с, а радиус диффузии 0,3 мкм, тогда как tж для НО2. – 10-3с, а радиус диффузии – 10 мкм.
Супероксид является довольно слабым окислителем и поэтому во многих биологических системах он может выступать в качестве донора электронов, восстанавливая ряд соединений. Так, реакции восстановления супероксидным анион-радикалом цитохрома с и нитросинего тетразолия широко используется для регистрации О2 ._ в биосистемах.
Реакции, в которые вступает О2 ._ , делятся на три группы:
1. депротонирование субстрата (НХ)
О2 ._ + НХ НО2. + х-
2. окисление:
х- + О2 ._ х. + О2 2-
3. восстановление
О2 ._ + х О2 + х-
В клетках супероксидный анион-радикал образуется в результате многих биохимических реакций. Различают несколько путей образования О2._ в живых системах:
1. неферментативное спонтанное аутоокисление ряда химических соединений (тиолов, флавинов, хинонов, катехоламинов, птеринов, а также гемоглобина и миоглобина).
1.1. Аутоокисление гемоглобина
Hb (Fe2+) + O2 О2._ + MetHb (Fe3+)
Содержание метгемоглобина в эритроцитах не должно превышать 3 %, т.к. превышение этого уровня приводит к гемолизу. MetHb-редуктаза восстанавливает MetHb до Hb. Окисление гемоглобина ускоряется при введении ряда гемолитических ядов, лекарственных веществ.
1.2. Аутоокисление катехоламинов
Дофамин + О2 → дофамин-семихинон + О2._ + Н+
Дофамин + О2._ + 2Н+→ дофамин-семихинон + Н2О2
2. Окислительно-восстановительные процессы, катализируемые металлофлавопротеидами, а также электрон-транспортные цепи митохондрий и микросом
2.1. Специализированной ферментной системой, образующей О2._ , является Ксантиноксидаза (КО; КФ 1.2.3.22).
В нормальных условиях фермент находится преимущественно в ксантиндегидрогеназной форме (КД; КФ 1.1.1.204; ксантин: НАДН-оксидоредуктаза) и может обратимо или необратимо переходить в оксидазную форму в результате соответственно окисления дисульфидных связей или ограниченного протеолиза. При ишемии органов наблюдается быстрая (в течение нескольких минут) конверсия КД в КО, что влечет за собой выработку О2._ и других АКМ.
Ксантин
дегидрогеназа
Ксантин
оксидаза (обратимая форма)

Рис. 2. Взаимопревращение изоформ ксантиноксидоредуктазы
КД КО – это группа из двух близких по структуре Mo6+ и Fe2+-содержащих ферментов. Данные изоферменты локализованы в большинстве органов, обладают широкой субстратной специфичностью. Они окисляют пурины (через гипоксантин и ксантин до мочевой кислоты), пиримидины, адреналин, дегидрируют НАДН, НАДФН. Максимальная концентрация КД – КО наблюдается в гепатоцитах, тонком кишечнике, эпителиальных и эндотелиальных клетках. В мозге, сердце, легких скелетных мышцах, почках содержание изоферментов низко, немного имеется в биологических жидкостях.
Основная функция КД – КО – катаболизм пуринов, при этом КД в качестве акцептора электронов использует НАД+, а КО – молекулярный кислород:
АТФ → АДФ→ АМФ → аденозин → инозин → гипоксантин →

→ ксантин → мочевая кислота

О2.
Рис. 3. Механизм функционирования ксантиноксидоредуктазы
Ген КО локализован в 22 хромосоме у человека и в 17 хромосоме у мыши. Базальная экспрессия КО человека низка, но усиливается под действием цитокинов (ИФ-, ИЛ-1,6, ФНО-α), гормонов (кортизола, пролактина), липополисахарида при гипоксии и особенно – при ишемии.
КО – гомодимер,
молекулярная масса субъединицы 150 кДа,
а димера – 300 кДа. Каждая субъединица
содержит 3 домена, связанные со
специфическими кофакторами. N-концевой
домен содержит два Fe2S2
центра, связанные с четырьмя остатками
цистеина. Промежуточный домен содержит
карман для ФАД, а с С-концевой домен
имеет молибденовый кофактор в форме
молибденоптерин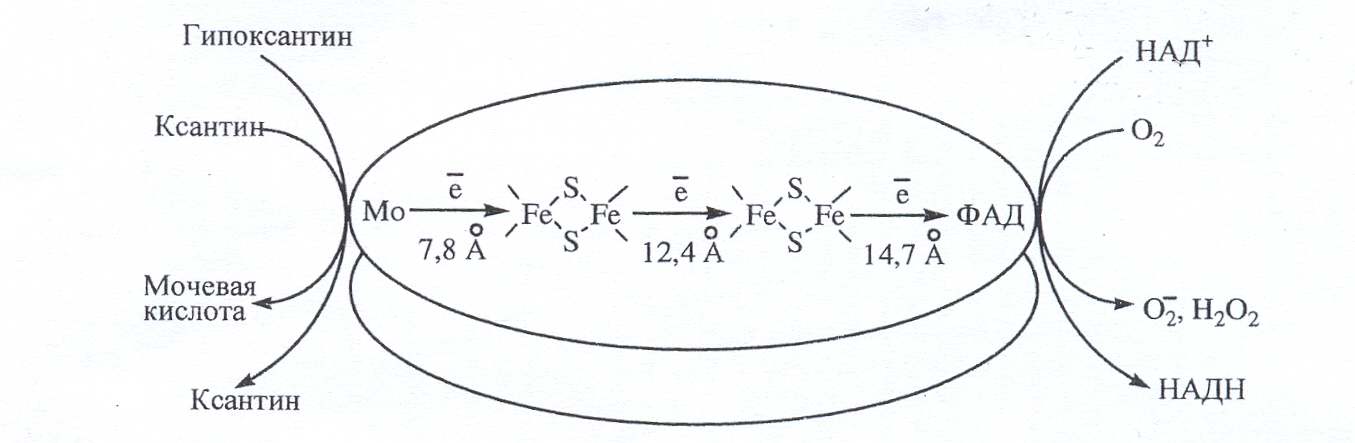 Рис. 4. Схема функционирования КД –
КО
Рис. 4. Схема функционирования КД –
КО
Ксантин и гипоксантин окисляются на Мо-ферменте, где Мо6+ восстанавливается до Мо4+, затем электроны через Fe2S2 центры переносятся на ФАД, а с ФАД-фрагмента на НАД+ или О2. Ингибиторами КО является аллопуринол, аллоксантин, фолиевая кислота.

Рис.5. Структура молибденового кофактора ксантиноксидазы
