
- •1. Расчетные химические задачи, их типы, овладение уч-ся по годам. Методические приемы формирования у уч-ся умения решать расчетные задачи по химии.
- •2. Растворы
- •4. Внеклассная работа по химии, её принципы, формы, направления.
- •7. Индивид. И дифференцир. Подходы к уч-ся в процессе обучения.
- •10. Методика формирования основ. Хим. Понятий. Этапы и пути. Развитие основн. Хим. Понятий.
- •11. Понятие о внутр. Энергии сис-мы и энтальпии. Теплота р-и, её термодинамические и термохимические обозначения. Закон Гесса и следствия из него.
- •13. Химический язык в школе. Структура. Значение формирования знаний химического языка.
- •14. Окислительно-восстановительные реакции.
- •17. Политехнизация знаний по химии.
- •18. Общая характеристика разбавленных р-ов неэлектролитов. Свойства р-ов. Роль осмоса в биологических процесса.
- •19. Производные карбоновых кислот: соли, галогенангидриды, ангидриды, эфиры, амиды и их взаимные переходы. Механизм реакции этерификации.
- •21. Формирование научного мировоззрения уч-ся при изучении химии в школе.
- •22. Химическая связь.
- •24. Методы обучения химии. Их клас-ция. Развив. Ф-ции.
- •25. Ионная связь.
- •26. Фенолы
- •Физические свойства
- •Химические свойства
- •26. Фенолы. Методы получения. Химические свойства: кислотность (влияние заместителей), реакции по гидроксильной группе и ароматическому кольцу.
- •27. Лекционно-семинарская система занятий по химии. Хар-ка структ. Эл-тов с-мы.
- •28. Общая характеристика и электронное строение атомов элементов V группы главной подгруппы. Аммиак, строение молекул, получение и свойства.
- •Аммиак (nh3)
- •29. Альдегиды, кетоны и карбоновые кислоты ароматического ряда. Способы получения и химические свойства.
- •30. Уроки обобщения знаний и умений уч-ся. Их особ-сти, класс-ция. Пути систематизации знаний.
- •31. Кислоты, основания, соли с точки зрения тэд.
- •33. Принципы обучения химии.
- •34. Обратимые и необратимые реакции.
- •36. Особенности урока химии как осн. Орг. Формы обучения. Типы, клас-ция уроков изучения новых знаний. Факторы, определяющие кач-во этих уроков.
- •37. Квантово-механическая модель строения атома.
- •39.Структура основных химических понятий, их формирование и развитие.
- •41. Ферменты
- •42. Наглядность в обучении химии. Виды и методы ее использования на уроках.
- •43. Металлы
- •44.Биосинтез белка. Этапы белкового синтеза. Строение рибосом и их роль в биосинтезе белка.
- •45. Химический кабинет в школе.
- •46. IV группа, гл. Подгруппа
- •Углерод
- •47. Рнк. Типы рнк. Структура рнк.Роль тРнк в биосинтезе белка.
- •48.Пути развития мышления учащихся при изучении химии в средней школе.
- •50. Одно – и многоатомные спирты
- •I. Реакции замещения
- •II. Реакции отщепления
- •III. Реакции окисления
- •II. Замещение гидроксильных групп
- •51.Демонстрационный эксперимент в обучении химии
50. Одно – и многоатомные спирты
Спирты (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп — ОН у насыщенных атомов углерода.
Общая формула спиртов: R(OH)m, m>1, где R — УВ радикал; m — число функциональных гидроксильных групп—ОН, которое определяет атомность спирта.
Классификация спиртов по строению УВ радикала:
Предельные
Ароматические
Непредельные: алкенолы и алкинолы.
Классификация спиртов по атомности:
Одноатомные
Многоатомные: двуатомные (этиленгликоль) и трехатомные (Глицерин)
Изомерия и номенклатура
Первые два члена гомологического ряда — СН3ОН и С2Н5ОН — не имеют изомеров, относящихся к классу спиртов. Для остальных алканолов возможны 2 типа изомерии (в пределах своего класса):
изомерия цепи (углеродного скелета);
изомерия положения функциональной группы
Спирты изомерны другому классу соединений — простым эфирам (R-O-R').
Электронное строение
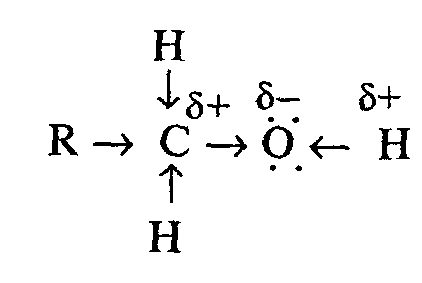
Атомы углерода в алканолах находятся в состоянии sp3 -гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С—О, О—Н. Дипольные моменты связей С →О и О ← Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ-, а атомы «С» и «Н» — частичные положительные заряды δ+. Полярность связи О—Н больше полярности связи С—О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н+. Поэтому спирты являются неэлектролитами.
Физические свойства
Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов.
Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов углерода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей.
• Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью (О, N, F, C1) другой молекулы. Чем большим положительным зарядом обладает атом водорода и чем больше способность другого атома отдавать свои неподеленные электронные пары, тем легче образуется водородная связь (ВС) и тем она прочнее.
Прочность ВС значительно меньше прочности ковалентной связи (КС): энергия (Е) образования ВС обычно не превышает 5—7 ккал/моль, средняя Е образования КС колеблется в пределах 80—110 ккал/моль.
Гомологическом ряду спиртов нет газообразных веществ.
Все алканолы легче воды, бесцветны, жидкие имеют резкий запах, твердые запаха не имеют. Метанол, этанол и пропанол неограниченно растворяются в воде, с увеличением числа углеродных атомов растворимость алканолов в воде уменьшается, высшие спирты не растворяются в воде.
Химические свойства
Химические свойства алканолов определяются особенностями их электронного строения: наличием в их молекулах полярных связей О—Н, С—О, С—Н. Для алканолов характерны реакции, которые идут с расщеплением этих связей: реакции замещения, отщепления, окисления.
