- •1. Классификация электрохимических методов анализа
- •2. Потенциометрия
- •2.1. Потенциометрическое титрование
- •2.1.1. Индикаторные электроды, преимущества потенциометрической индикации конечной точки титрования
- •2.1.2. Кислотно-основное титрование
- •2.1.3. Потенциометрическое титрование в неводных средах
- •2.1.4. Индикация конечной точки потенциометрического титрования
- •2.2. Прямая потенциометрия. Ионометрия.
- •2.2.1. Ионоселективные мембранные электроды и их классификация
- •2.2.2. Ионоселективные электроды с твердыми мембранами
- •2.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •2.2.4. Ионоселективные электроды с жидкими мембранами
- •2.2.5. Газочувствительные электроды
- •2.2.6. Потенциометрические биосенсоры
- •2.2.7. Ионоселективные полевые транзисторы
- •2.2.8. Ионоселективные микроэлектроды
- •3. Электрогравиметрия и кулонометрия
- •3.1. Законы электролиза
- •3.2. Электрогравиометрический анализ
- •3.3. Кулонометрия
- •3.3.1. Классификация кулометрических методов
- •3.3.2. Прямая потенциостатическая кулонометрия
- •3.3.3. Прямая амперостатическая кулонометрия
- •3.3.4. Кулонометрическое титрование при постоянной силе тока
- •15.6. Электрогенерирование кулонометрических титрантов в неводных средах
2.2.2. Ионоселективные электроды с твердыми мембранами
Для нахождения функции отклика мембранного электрода, рассмотрим поведение твердой катионообменной мембраны, которая разделяет растворы, содержащие катионы А+ и В+ в разных концентрациях. В объеме мембраны имеется определенное число мест, способных связывать указанные ионы. Последние проникают в мембрану и занимают эти места, играя роль противоионов. Их заряд компенсируют фиксированные ионы мембраны. При этом равновесия ионного обмена между раствором и мембраной
A+р-р = А+мб,
В+р-р = В+мб
можно описать соотношениями
![]() ,
(2.76)
,
(2.76)
![]() .
(2.77)
.
(2.77)
Отношение КА/КВ=Кобм является константой обмена реакции
В+р-р + А+мб = В+мб + А+р-р
Константа обмена ионов, которая определяет способность ионов В+ вытеснять из мембраны ионы А+
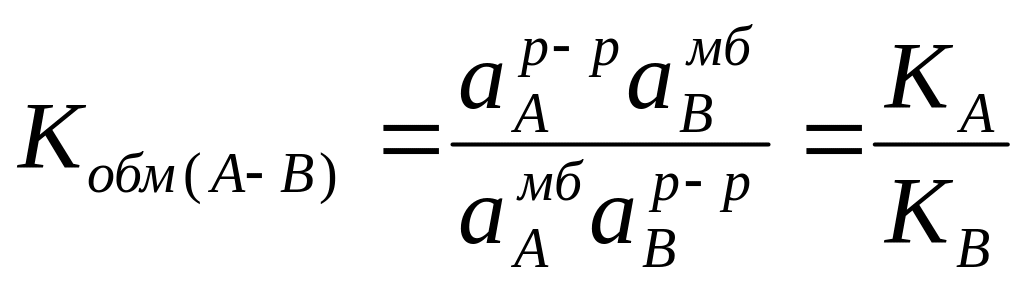 .
(2.79)
.
(2.79)
При условии, что протекающий через мембрану электрический ток близок к пулю, а сумма активностей ионов А+ и В+ в мембране постоянна (а=аАмб+аВмб), можно записать:
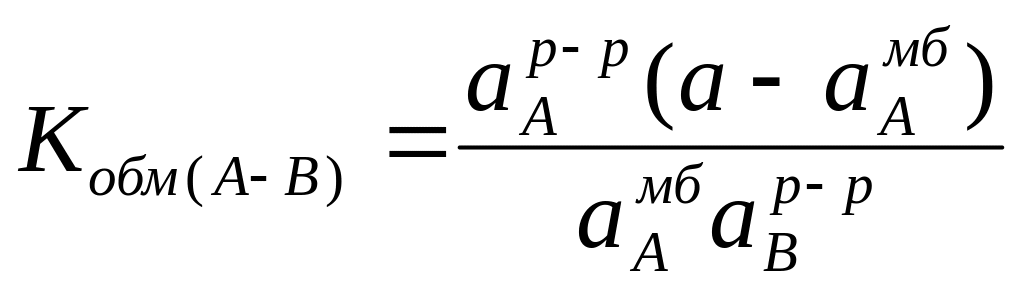 .
(2.80)
.
(2.80)
Преобразуя данное уравнение, получим
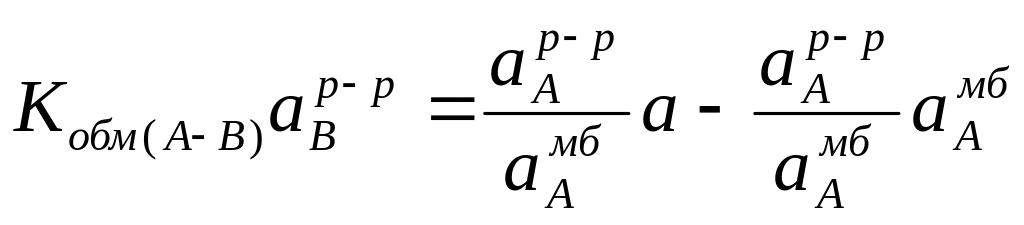
Записав выражение относительно aAр-р / aAмб, получим соотношение
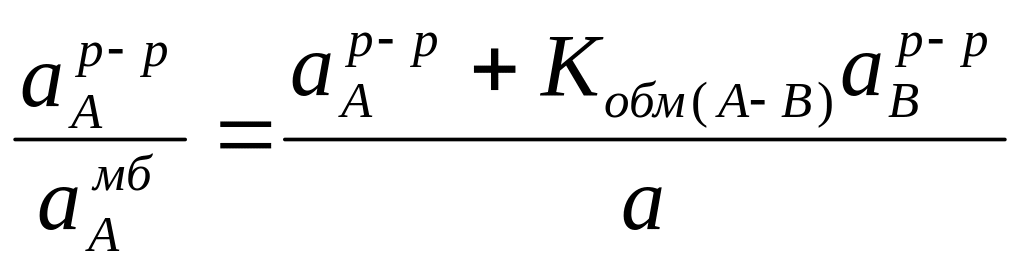 .
(2.81)
.
(2.81)
Тогда для потенциала мембранного электрода, учитывая (2.74), имеем выражение
![]() ,
(2.82)
,
(2.82)
где постоянная для данного электрода величина RT/F∙lna входит в значение потенциала Е°.
Однако оно не учитывает диффузионный потенциал, возникающий из-за различий в активностях потенциалопределяющих ионов в поверхностных слоях мембраны, прилегающих к внутреннему и внешнему раствору. Его величина зависит от чисел переноса t ионов в мембране; например, для иона А число переноса
![]() ,
(2.83)
,
(2.83)
где uA и uB – подвижности ионов А+ и В+ в мембране, аА и аB – соответствующие активности ионов в мембране.
С учетом этого получим следующее выражение для потенциала мембранного электрода:
![]() .
(2.84)
.
(2.84)
Величина (иB/иА)Кобм(А-В) в этом выражении называется коэффициентом селективности (КA/B) электрода по отношению к ионам А+ и является основным параметром, характеризующим селективность мембранного электрода. Селективность электрода зависит также от соотношения активностей определяемых и мешающих ионов (аА/аB), Чем меньше КA/B, тем более селективен электрод по отношению к определяемому иону.
Коэффициент селективности можно определить экспериментально, измеряя потенциал электрода в растворах с постоянной активностью мешающего иона аВ и изменяющейся активностью определяемого иона аА (метод смешанных растворов). Значение КA/B рассчитывают из соотношения
![]() ,
(2.85)
,
(2.85)
где nA и nB – заряды ионов; ах - активность иона А+ в точке, в которой наблюдается заметное отклонение потенциала электрода от нернстовской функции.
По методу отдельных растворов измеряют потенциал электрода в растворе определяемого иона в отсутствие мешающего иона (Eа), а затем в растворе мешающего иона в отсутствие определяемого иона (EB), причем активности ионов в этих растворах должны быть одинаковыми. Если соответствующие значения потенциалов для обоих ионов описываются уравнением Нернста, то lg КA/B можно рассчитать из зависимости:
![]() .
(2.86)
.
(2.86)
Этот метод следует применять только тогда, когда нельзя или нецелесообразно использовать метод смешанных растворов.
Из выражения видно, что селективность электрода по отношению к иону А+ будет тем больше, чем селективней поглощается он мембраной и чем более подвижен внутри нее. В общем случае влияние мешающих ионов на потенциал мембранного электрода можно выразить с помощью уравнения Никольского:
![]() ,
(2.87)
,
(2.87)
где знак «+» для катионов, а «–» – для анионов; nA и nB – заряды определяемых и мешающих ионов; aА и аB – соответствующие активности ионов в растворе; Ка/в - коэффициент селективности.
Идеальный ИСЭ должен обладать специфическим откликом на определяемый ион, причем влияние посторонних ионов должно быть пренебрежимо малым. Однако за исключением сульфидсеребряного электрода, селективного к сульфид-ионам и ионам серебра, ни один из известных в настоящее время ионоселективных электродов не обладает идеальной специфичностью. Подавляющее большинство ИСЭ имеют лишь относительную селективность, т.е. селективность к тому или иному иону относительно других ионов.
Встречаются также электроды с неидеальной электродной функцией, зависимость потенциала которых от lg КA/B линейная, но угловой коэффициент
ниже нернстовского значения.
Мембраны в ИСЭ чаще всего представляют собой моно- или поликристаллы трудно растворимых в воде солей. В этих мембранах обычно один из двух составляющих соль ионов способен под действием электрического поля перемещаться в кристаллической решетке по ее дефектам. Примерами могут служить мембраны из солей галогенидов серебра, которые обладают ионной проводимостью, осуществляемой ионами серебра. Поведение этих мембран, в простейших случаях, идентично поведению соответствующих электродов второго рода (хлорсеребряного и каломельного). Тонкая пластинка из монокристалла, например, хлорида серебра, может быть мембраной электрода, обратимой по отношению к иону Сl-, который закреплен в кристаллической решетке. В то же время такой электрод обладает и катионной Ag+ - функцией за счет постоянства произведения растворимости ПPAgCl.
Кристаллические мембраны отличаются очень высокой селективностью, превышающей селективность жидкостных электродов (с ионообменными веществами) на несколько порядков. Это связано с тем, что селективность у твердых кристаллических мембранных электродов достигается за счет вакансионного механизма переноса заряда, при котором вакансии заполняются только определенным подвижным ионом (Ag+), так как форма, размер, распределение заряда вакансии соответствуют только определенному подвижному иону.
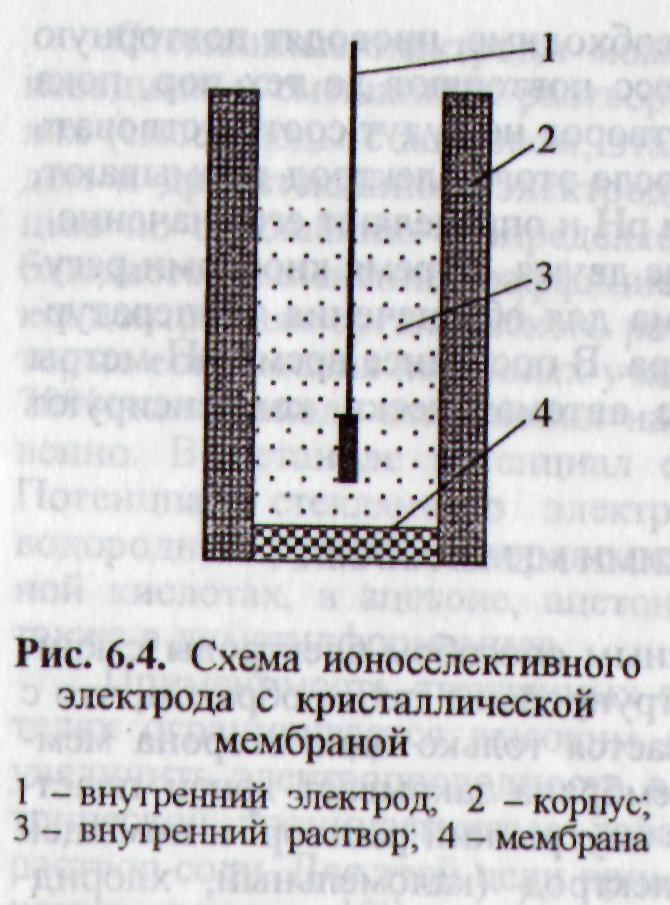
Конструкция электродов с кристаллическими мембранами показана на рис. 2.23. Как правило, мембрана закрывает конец пластмассовой трубки,
|
в которую залит внутренний раствор и помещен подходящий вспомогательный электрод (каломельный, хлорсеребряный и т.п.). Внутренний раствор и внутренний электрод сравнения в ходе всех измерений остаются неизменными. Выражение для ЭДС элемента, который составлен из интересующего нас раствора, погруженного в него ионоселективного электрода и внешнего |
Рис. 2.23. Схема ионселективного электрода с кристаллической мембраной: 1 − внутренний электрод; 2 − корпус; 3 − внутренний раствор; 4 − мембрана |
электрода сравнения, включает слагаемое, зависящее от активности определяемого иона, и константу: |
![]() .
(2.88)
.
(2.88)
В нее входят скачки потенциала на границах раздела фаз, кроме границы мембрана/исследуемый раствор. Для каждого мембранного электрода величину константы определяют путем его градуировки по стандартным растворам.
В качестве стандартных растворов для градуировки ионоселективных электродов применяют водные растворы солей с концентрациями, охватывающими весь диапазон функции электрода Там, где это возможно, для стандартизации электродов с катионной функцией рекомендуется использовать растворы полностью диссоциирующих хлоридов, а для градуировки электродов с анионной функцией - растворы натриевых солей этих анионов (табл. 6.3). Для повышения точности измерений электроды в течение нескольких минут промывают в дистиллированной воде и высушивают впитывающей влагу тканью. Одинаковым во всех случаях должно быть и перемешивание. Время ожидания достижения равновесных значений потенциала также должно быть одинаковым (от 2 до 10 мин ). Желательно проводить градуировку электродов по двум растворам, что уменьшает ошибку, вызванную неидеальностью электродной функции и остаточным диффузионным потенциалом.
К электродам с твердой мембраной относятся: лантанфторидный электрод, сульфидсеребряные электроды, галогенсеребряные электроды, электроды на основе сульфидов (халькогенидов) некоторых двухзарядных ионов металлов, стеклянные электроды.
Наиболее совершенным и высокоселективным электродом для определения F- ионов является монокристаллический лантанфторидный электрод. У этого электрода F- функция сохраняется до концентрации ионов F-~10-5 – 10 -7 М, т.е. значительно меньшей, чем рассчитанная из литературных данных о растворимости фторида лантана. Это свойственно и другим электродам на основе моно- и поликристаллов. Электродный потенциал LaF3 электрода подчиняется уравнению Нернста в интервале концентраций 100–10-6 М
![]() .
(2.89)
.
(2.89)
Селективность LаF3−электрода в присутствии многих других анионов может быть охарактеризована возможностью определения активности ионов F- при более чем 1000-кратных избытках галоген-ионов, NO3-, PO43-, НСО3- и других анионов. Существенно мешают определению aF- -только катионы, дающие комплексы с фторидами (Al3+, Fe3+, Ce4+, Li+, Th4+) и анионы ОН-. Мешающие катионы обычно маскируют добавлением цитрата натрия. При высоких значениях рН на поверхности электрода может образоваться слой La(OH)3, растворимость которого соизмерима с растворимостью LaF3. В результате освобождается дополнительное количество ионов фтора, что приводит к уменьшению электродного потенциала. Поэтому рН растворов поддерживают постоянным с помощью буферных растворов в диапазоне 5,0 - 5,5.
В растворах, содержащих карбоксильные кислоты поверхность электрода и, соответственно, потенциал лантанфторидного электрода изменяются, за счет образования смешанных солей фторида и аниона карбоксильных кислот Поверхность можно вернуть к первоначальному состоянию, после выдерживания электрода в буферном и чистом растворах фторида натрия.
Потенциал в концентрированных растворах устанавливается менее чем за 0,5 с, а при низких концентрациях - до 3 мин. Стабильность потенциала F- -электрода достаточна для длительной работы без периодических калибровок (изменение потенциала примерно ±2 мВ в неделю). Применяют лантанфторидный электрод для определения ионов F- в различных жидких средах и твердых веществах, для анализа биологических материалов, сточных вод, минеральных удобрений, фармацевтических средств.
Фторидный электрод можно использовать и для прямого определения концентрации ионов лантана в растворах, не содержащих фторид-ионов. Если анализируемый раствор находится в равновесии с мембраной из LaF3, то концентрация ионов фтора вблизи поверхности электрода определяется произведением растворимости
ПPLaF3=аLaF3+ aF-3 , (2.90)
При подстановке (2.90) в (2.89) получим
![]() .
(2.91)
.
(2.91)
Хотя прямое определение лантана с помощью фторидного электрода в аналитической практике используется довольно редко, тем не менее, тот факт, что кристаллический мембранный электрод можно применять для определения ионов, не способных перемещаться в решетке мембраны, имеет важное значение.
Сульфидсеребряные электроды – этот вид электродов является универсальным и получил широкое распространение. С одной стороны Ag2S является основой одного из первых гомогенных кристаллических электродов с высокой избирательностью по отношению к ионам Ag+ и S2-, с другой стороны - Ag2S оказался превосходной инертной матрицей для кристаллических галогенидов серебра и многих сульфидов двухзарядных металлов.
Сульфид серебра обладает ионной проводимостью; способность к миграции имеет только ион серебра. В качестве мембраны можно использовать монокристаллы Ag2S или спрессованный поликристаллический сульфид серебра. Чрезвычайно малая растворимость последнего и хорошая устойчивость по отношению к окислителям и восстановителям, а также простота приготовления поликристаллических мембран сделали сульфид серебра идеальным материалом для создания ионоселективных электродов. Сульфидсеребряный электрод применяют для определения, как ионов серебра, так и сульфид-ионов, поскольку эти ионы связаны между собой произведением растворимости Ag2S. Так как мембрана обладает плотной и непористой поверхностью, то реакция электрода на изменение активности сульфидных ионов в растворе очень быстрая.
Сульфидсеребряный электрод в растворах AgNO3 обладает полной Ag+ функцией в интервале концентраций 100–10-7 М Ag+. Нижний концентрационный предел обусловлен нестабильностью растворов при концентрации ниже 10-7 М Ag+. S2--функция экспериментально выполняется в интервале от 10-2 до 10-7 М в сильнощелочных сульфидных растворах. На потенциал рассматриваемого электрода влияют Hg2+ и CN- ионы. Влияние ионов CN- обусловлено реакцией:
6CN- + Ag2S => S2- + 2Ag(CN)32-.
В обычной конструкции ионоселективного электрода с твердой мембранной внутренняя поверхность мембраны контактирует со стандартным раствором электролита, в который погружен вспомогательный электрод, создающий обратимый переход от ионной проводимости в электролите к электронной проводимости в металлическом проводнике. В последнее время внутренний контакт создают с помощью твердых веществ (Ag, графит) - такие электроды называются твердофазными. Однако с точки зрения воспроизводимости и стабильности показаний они уступают электродам с внутренним электродом сравнения.
Галогенсеребряные и некоторые другие электроды на основе соединений серебра. Для определения концентрации галоген-ионов используют электроды на основе солей серебра. гомогенные Электроды с твердыми гомогенными мембранами или монокристаллами, принципиально не отличаются от так называемых гетерогенных, мембраны которых содержат такие же труднорастворимые соли, внедренные в пластическую матрицу. Проводимость в AgX - мембранах осуществляется ионами Ag+ по дырочному механизму Френкеля. Мембранная фаза имеет постоянный состав, и диффузионный потенциал внутри мембраны равен нулю. Потенциал галоген серебряных электродов подчиняется уравнению Нернста.
Хотя хлорид, бромид и иодид серебра являются соединениями с ионной проводимостью, в которых перенос заряда осуществляется ионами Ag , при комнатной температуре они имеют довольно высокое сопротивление, а также значительный фотоэлектрический потенциал. Поэтому такие электроды можно использовать только в условиях постоянного освещения, что создает определенные трудности. Кроме того мембраны из чистого иодида серебра не устойчивы и легко растрескиваются (это вызвано тем, что твердый иодид серебра в зависимости от температуры и давления может находиться в различных модификациях).
Указанные недостатки галогенидов серебра устраняются при изготовлении мембран из сульфида серебра, в котором диспергированы тонко измельченные соответствующие галогениды. Поскольку последние имеют более высокую растворимость, чем сульфиды, то сульфид серебра можно рассматривать как химически инертную матрицу с включенными в нее частицами активного вещества. В этом случае на поверхности мембраны галогенид серебра находится в равновесии с анализируемым раствором и активность ионов Ag можно найти по формуле
![]() .
(2.92)
.
(2.92)
Подставив ее в уравнение Нернста, можно получить выражение, которое показывает, что электрод с мембраной из смеси сульфида и галогенида серебра ведет себя как электрод с чисто галогенидной функцией. Для изготовления подобных мембран можно использовать и другие соли серебра. Основное требование, предъявляемое к ним, сводится к тому, чтобы их растворимость была существенно выше растворимости сульфида серебра, но оставалась достаточно низкой, чтобы равновесная концентрация соли серебра не превышала активности аниона в исследуемом растворе.
Градуировочная кривая мембранных электродов, приготовленных из смеси сульфида серебра и тех или иных серебряных солей, идентична по форме кривым для электродов с мембранами из чистых солей серебра. Нижняя граница определяемых концентраций зависит от произведения растворимости соответствующих галогенидов серебра и составляет для AgCl-Ag2S-элeктpoдa 5∙10-5 моль/л; для AgBг-Ag2S-элeктpoдa около 5∙10-6 моль/л и для Agl-Ag2S-элeктpoдa приблизительно 5∙10-8 моль/л. Потенциалы электродов зависят также от присутствия тех анионов, которые дают с серебром менее растворимые соединения, чем определяемый ион. В этом случае на поверхности мембраны образуется осадок, что приводит к искажению результатов определений. Число мешающих ионов уменьшается в ряду: Сl-, Вr-, I-, S2-. Указанные электроды не могут применяться для анализа растворов, содержащих сильные восстановители, так как на поверхности мембраны образуется слой металлического серебра. Недопустимо и присутствие ртути.
В галогенидных электродах других модификаций для получения мембран используют также смеси Hg2Cl2-HgS, Hg2Br2-HgS, Hg2Cl2-AgCl, Hg2Cl2-Ag2S.
Потенциометрическое определение с галогенсеребряным электродом осложняется присутствием в исследуемом растворе сульфида, тиосульфата и цианата или восстановителей.
Кроме галогенсеребряных электродов используют и ионоселективные CN- и SCN- - электроды. Определению цианид-ионов с помощью цианид-селективного электрода не мешают Cu2+, Fe3+, MnO4-, а также хлорид- и бромид-ионы. В анализируемом растворе не должны содержаться ртуть, сульфид-ионы и сильные восстановители. Для предотвращения снижения концентрации цианид-ионов из-за образования HCN, величина рН должна быть выше 10.
Электрод пригоден для определения цианид-ионов в диапазоне концентраций от 10-2 до 10-6 моль/л. Следует иметь ввиду, что при концентрации цианида выше 10-3 моль/л время жизни электрода значительно сокращается вследствие медленного растворения мембраны из-за образования растворимых комплексов серебра с цианид-ионами.
Для определения тиоцианат-ионов применяют тиоцианат-селективный электрод, мембрану которого изготавливают из смеси тиоцианата и сульфида серебра. Данный электрод чувствителен к тиоцианат-ионам в диапазоне концентраций 5∙10-6 - 1,0 моль/л в интервале рН от 2 до 10. Анализируемый раствор не должен содержать сильных восстановителей и анионов, образующих с серебром малорастворимые соли, а также Hg2+. Во всех указанных случаях электрод выходит из строя из-за отравления мембраны.
Электроды на основе сульфидов (халъкогенидов) некоторых двузарядных ионов металлов. Мембраны для этого вида электродов получают из смесей сульфида серебра и сульфида (халькогенида) соответствующего металла. Наибольшее значение для практики имеют: медный, свинцовый и кадмиевый электроды. Поскольку такие мембраны содержат достаточное количество Ag2S, чтобы обеспечить движение ионов серебра в мембране, то они имеют серебряную функцию. Чувствительность электродов к указанным ионам основана на равновесных процессах
М2+ + S2- = MS и 2Ag+ + S2- = Ag2S,
где М2+ - двухзарядный ион металла; MS - сульфид металла, находящийся в виде тонкоизмельченного порошка в матрице сульфида серебра.
Активность ионов Ag+ на границе раствор/мембрана при допущении, что исследуемый раствор не содержит ионов серебра, определяется выражениями
![]() и
и
![]() ,
(2.93)
,
(2.93)
где
 .
(2.94)
.
(2.94)
Подстановкой (2.94) в уравнение Нернста для серебряного электрода получим выражение для потенциала электрода этого типа:
![]() .
(2.95)
.
(2.95)
Таким образом, в растворах, содержащих ионы М2+ и не содержащих Ag+, электрод становится чувствительным к ионам этих металлов. Чтобы сульфид металла был пригоден для изготовления мембраны, он должен удовлетворять определенным требованиям. Прежде всего необходимо, чтобы его произведение растворимости на несколько порядков превышало ПРAg2S. Если это требование не выполняется, то ионы металла отсутствуют на поверхности мембраны, так как равновесие
М2+ + Ag2S = MS + 2Ag+
сдвинуто вправо. В то же время величина ПРMS должна быть достаточно малой, чтобы равновесная концентрация М2+ в растворе была ниже ожидаемой концентрации исследуемого иона в пробе. Необходимо также, чтобы электрод имел приемлемое время установления потенциала. Это наблюдается в том случае, когда сульфиды, находящиеся в мембране, быстро приходят в равновесие с ионами анализируемого раствора.
Для электродов с мембраной из смеси сульфидов серебра и другого металла определению последнего мешают катионы, которые образуют с сульфид-ионами менее растворимые осадки, чем определяемые ионы. Прежде всего это ионы серебра и ртути. Концентрация ионов железа должна составлять десятую часть от концентрации ионов меди и не превышать концентрацию ионов свинца. Это условие легко выполнить, поддерживая рН в растворе выше 4,0. Определению кадмия мешают серебро, ртуть, медь, железо и свинец.
При анализе растворов, содержащих ионы, которые образуют прочные соединения с компонентами мембраны, могут возникнуть осложнения. Характер влияния мешающих ионов в этом случае связан с образованием новой твердой фазы.
Электроды на основе сульфида серебра и сульфидов двухзарядных ионов металлов применимы в широком диапазоне концентраций определяемых ионов – от 10-1 до 10-7 моль/л. Верхняя граница этого диапазона находится в области насыщенных растворов, а нижний предел зависит от рН, что связано с увеличением растворимости сульфидов металлов в кислых растворах из-за образования HS и H2S. Градуировочные кривые имеют наклон, близкий к теоретическому, рассчитанному по уравнению Нернста. Следует учитывать, что при увеличении рН раствора начинают осаждаться гидроксиды Cu2+, Cd2+ и РЬ2+. Это приводит к уменьшению содержания определяемых ионов в анализируемых растворах. Чтобы избежать осаждения гидроксидов, необходимо строго контролировать рН.
Наряду с кристаллическими мембранами в ИСЭ используются также гетерогенные мембраны (мембраны Пунгора), в которых твердый материал с ионной проводимостью в виде тонкодисперсного порошка помещен в инертную матрицу. Благодаря этому удается получить мембраны из соединений, которые не образуют кристаллы. В качестве активных веществ в таких мембранах применяют самые разнообразные материалы (труднорастворимые соли металлов, оксиды, карбиды, бориды, силициды, хелатные соединения, ионообменные смолы), а в качестве связующего материала - парафин, коллодий, поливинилхлорид, полистирол, полиэтилен, силиконовый каучук и др. Разработаны электроды с мембранами, селективными по отношению к ионам F-, Сl-, Вr-, I-, S2--, Ag+, Ва2+,Са2+, SO42-, PO43-, а также ртутный электрод с мембраной из HgS или HgSe в эпоксидной матрице. Некоторые из электродов выпускаются промышленностью. Считается, что они менее чувствительны к окисляющим и восстанавливающим агентам, чем электроды с кристаллическими мембранами. По механизму действия мембраны Пунгора не отличаются от аналогичных мембран из спрессованных порошковых дисков.
Свойства гетерогенных мембран существенно зависят от свойств связующего материала, который определяет их химическую стойкость, механическую прочность и смачиваемость. В последнее время в качестве связующего материала широко применяют силиконовый каучук. Он имеет идеальные гидрофобные свойства, а эластичность, сопротивление растрескиванию и относительно малое набухание силиконового каучука в водных растворах делают его наиболее ценным связующим материалом.
Для изготовления гетерогенных мембран силиконовый каучук смешивают с активным веществом и полученную массу прессуют до пленок толщиной ~ 0,5 мм. В качестве активного вещества чаще всего применяют труднорастворимые соли металлов типа хлоридов, сульфатов или фосфатов. Оптимальные размеры частиц 1-15 мкм. Соотношение активного вещества и связующего материала ~ 50%. Для успешной работы электрода весьма важно, чтобы отдельные частички активного вещества находились в контакте друг с другом, что обеспечивает перенос заряда через мембрану. Большое значение имеет последующая обработка мембраны. Обычно ее в течение нескольких часов вымачивают в соответствующем растворе.
Одним из первых электродов такого типа был электрод с мембраной, содержащей осадок сульфата бария, потенциал которого зависит от концентрации сульфат-ионов в диапазоне 10-1 – 10-6 моль/л. Его селективность относительно невелика. Разработаны электроды на основе галогенидов и сульфидов серебра, фосфата Мn3+, фторидов тория, лантана и кальция, комплексов никеля с диметилглиоксимом. Так же, как и для электродов с кристаллическими мембранами, нижняя граница определяемых концентраций для электродов с гетерогенными мембранами зависит от растворимости применяемых осадков.
Выпускаются также электроды, мембрана которых изготовлена из проводящего материала, состоящего из графита и политетрафторэтилена, пропитанного сульфидом соответствующего металла. При необходимости обновления мембраны срезают тонкий наружный слой электрода и свежую поверхность вновь пропитывают сульфидом металла. Недостатком таких электродов является необходимость их специальной подготовки перед применением в отличие от электродов с готовыми мембранами.