- •1. Классификация электрохимических методов анализа
- •2. Потенциометрия
- •2.1. Потенциометрическое титрование
- •2.1.1. Индикаторные электроды, преимущества потенциометрической индикации конечной точки титрования
- •2.1.2. Кислотно-основное титрование
- •2.1.3. Потенциометрическое титрование в неводных средах
- •2.1.4. Индикация конечной точки потенциометрического титрования
- •2.2. Прямая потенциометрия. Ионометрия.
- •2.2.1. Ионоселективные мембранные электроды и их классификация
- •2.2.2. Ионоселективные электроды с твердыми мембранами
- •2.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •2.2.4. Ионоселективные электроды с жидкими мембранами
- •2.2.5. Газочувствительные электроды
- •2.2.6. Потенциометрические биосенсоры
- •2.2.7. Ионоселективные полевые транзисторы
- •2.2.8. Ионоселективные микроэлектроды
- •3. Электрогравиметрия и кулонометрия
- •3.1. Законы электролиза
- •3.2. Электрогравиометрический анализ
- •3.3. Кулонометрия
- •3.3.1. Классификация кулометрических методов
- •3.3.2. Прямая потенциостатическая кулонометрия
- •3.3.3. Прямая амперостатическая кулонометрия
- •3.3.4. Кулонометрическое титрование при постоянной силе тока
- •15.6. Электрогенерирование кулонометрических титрантов в неводных средах
2.1.4. Индикация конечной точки потенциометрического титрования
Как указывалось выше, наиболее распространенным приемом определения КТТ является классический графический способ, который заключается в построении интегральной кривой титрования или дифференциальной титрования. Точка перегиба, в которой кривая титрования E=f(V) имеет максимальную крутизну, принимается за КТТ. Точка максимального наклона интегральной кривой титрования отвечает точке максимума на кривой dE/dV=f(V) и точке, в которой кривая d2E/dV2=f(V) пересекает ось абсцисс.
Расчетный графический метод Грана основан на линеаризации кривых титрования путем построения зависимости ΔV/ΔE–V. В этом случае кривая титрования трасформируется в две линейные ветви, точка пересечения которых в идеальном случае совпадает с ТЭ.
Удобным и распространенным методом является титрование до заданного потенциала, отвечающего точке эквивалентности (ЕТЭ).
Для осуществления такого титрования необходимо либо рассчитать ЕТЭ., пользуясь приведенными выше уравнениями для различных типов реакций, либо определить этот потенциал экспериментально. Измерение потенциала ЕТЭ. проводят в стехиометрическом стандартном растворе, состав которого идентичен составу исследуемого раствора в точке эквивалентности, или в предварительно оттитрованном растворе. Зная потенциал индикаторного электрода в ТЭ и потенциал электрода сравнения, находят ЭДС электродной системы, и титруют испытуемый раствор до достижения этого значения ЭДС.
При использовании компенсационной схемы на потенциометре перед началом титрования устанавливают значение ЭДС электродной системы для момента эквивалентности, и ведут титрование до отсутствия тока в цепи гальванометра. Поэтому такое титрование известно также под названием “титрование до нуля”. Оно может быть выполнено и в нескольких других вариантах, не требующих применения компенсационной схемы, например
|
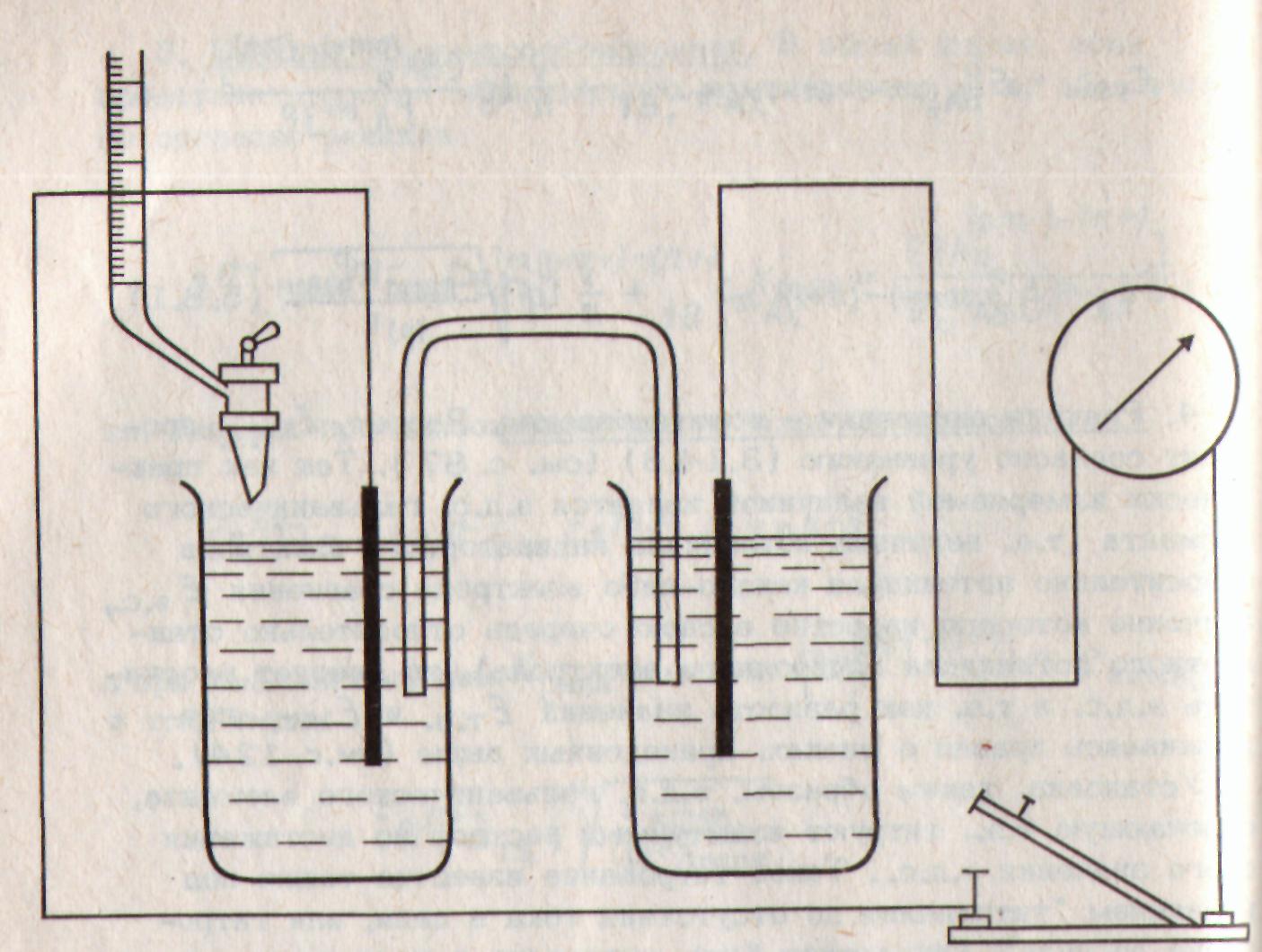
титрование по методу Пинкгофа, Тредвела и Мюллера. Они применили два одинаковых индикаторных электрода, один из которых погружен в испытуемый раствор, а другой в раствор, не отличающийся по составу от титруемого в ТЭ или просто предварительно оттитрованную пробу. Электроды замкнуты через гальванометр (рис. 2.16). Титрование в этом некомпен-сационном методе ведут до отсутствия |
Рис. 2.16. Схема установки для титрования до потенциала ТЭ. |
тока или “броска” стрелки гальванометра Недостатком этого метода является |
существенная поляризация электродов в недотитрованных или перетитрованных растворах, что может привести к серьезным ошибкам.
Автоматизация титрования до заданного потенцила заключается в автоматическом отключении бюретки при достижении потенциала точки эквивалентности (такой вариант реализован в отечественном титраторе БАТ-15). При этом необходимо предотвратить возможность перехода за конечную точку. Поэтому в начале титрования титрант обычно подается с большой скоростью, затем после достижения заранее заданного потенциала скорость подачи титранта снижается и поддерживается постоянной вплоть до достижения конечной точки. В данном случае становятся важными как расположение электродов, так и перемешивание раствора, потому что изменение концентрации вблизи индикаторного электрода должно происходить точно так же, как и в основной массе раствора. Для проведения титрования описанным способом необходимо использовать электронную схему, которая сравнивает фактический потенциал электрода с заранее заданным и отключает бюретку в тот момент, когда эти потенциалы сравняются.
Существенные преимущества имеет автоматизированный способ титрования до точки максимального наклона, т.к. в этом случае не обязательно знать точное значение потенциала электрода в КТТ и не столь жестки требования к расположению индикаторного электрода. В этом методе отключение бюретки производится в тот момент, когда скорость изменения потенциала dE/dV достигает максимального значения.
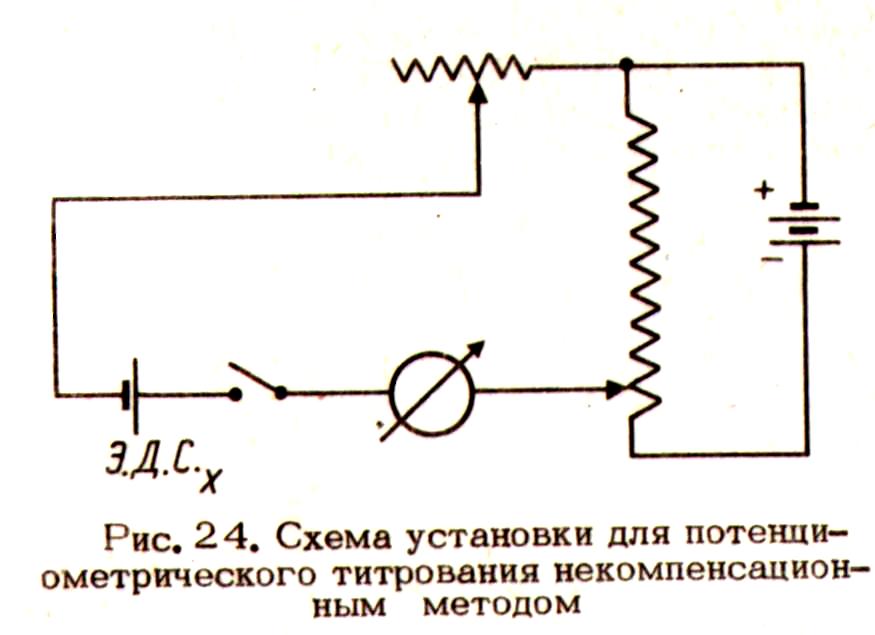
“Некомпенсационный” метод титрования Он основан на регистрации в процессе титрования силы тока в замкнутой цепи, приведенной на рис. 2.17.
|
ЭДС испытуемого гальванического элемента до начала титрования компенсируют равным налагаемым извне напряжением, при этом ток в цепи отсутствует. В ходе титрования вследствие изменения ЭДС гальванического элемента в цепи возникает ток который измеряют миллиамперметром. Так как максимальное |
Рис. 2.17. Схема установки для потенциометрического титрования некомпенсационным методом |
изменение ЭДС происходит в ТЭ, то в этот момент наблюдается максимальное возрастание тока. После ТЭ ток в цепи |
меняется в меньшей степени, так как ЭДС мало меняется при добавлении порций титранта. КТТ можно найти по зависимости I от V или I/V от V.
Для предотвращения поляризации электродов в элементе при прохождении тока последовательно к титрационной ячейке включают большое сопротивление (несколько кОм). В некоторых случаях можно настолько увеличить внешнее сопротивление, что до т.э. ток в цепи практически отстутствует и появляется только в момент максимального изменения э.д.с. Такое возникновение тока можно фиксировать как достижение к.т.т. без дальнейшей обработки результатов измерений.
Титрование с биметаллической парой электродов. Метод основан на измерении разности потенциалов, которая возникает между двумя электродами из разных материалов, погруженными непосредственно в титруемый раствор. В этих случаях используется то обстоятельство, что при достижении в процессе титрования исчезающе малой концентрации (10-5 М) одной из сопряженных форм обратимой ред-окс пары или же в растворе необратимой ред-окс системы (т.е. при образовании смешанных предельных потенциалов) поведение подобных электродов различно.
В качестве таких электродов успешно могут быть использованы в ред-окс реакциях платина - углерод, платина - вольфрам, платина - родий, платина - палладий и др.
Если титруемое и титрующее вещества являются компонентами обратимых ред-окс систем, то изменение потенциала каждого электрода до т.э. одинаково, поэтому разность потенциалов Е между ними практически равна нулю. Как только концентрация титруемого вещества изменится настолько, что возникает смешанный потенциал, величина которого существенно зависит от материал электрода, между электродами создается большая разность потенциалов, указывающая на достижение конечной точки. После точки эквивалентности с появлением другой обратимой ред-окс системы, к которой принадлежит титрант, потенциалы электродов снова становятся практически равными. Ход титрования изображается дифференциальной кривой.
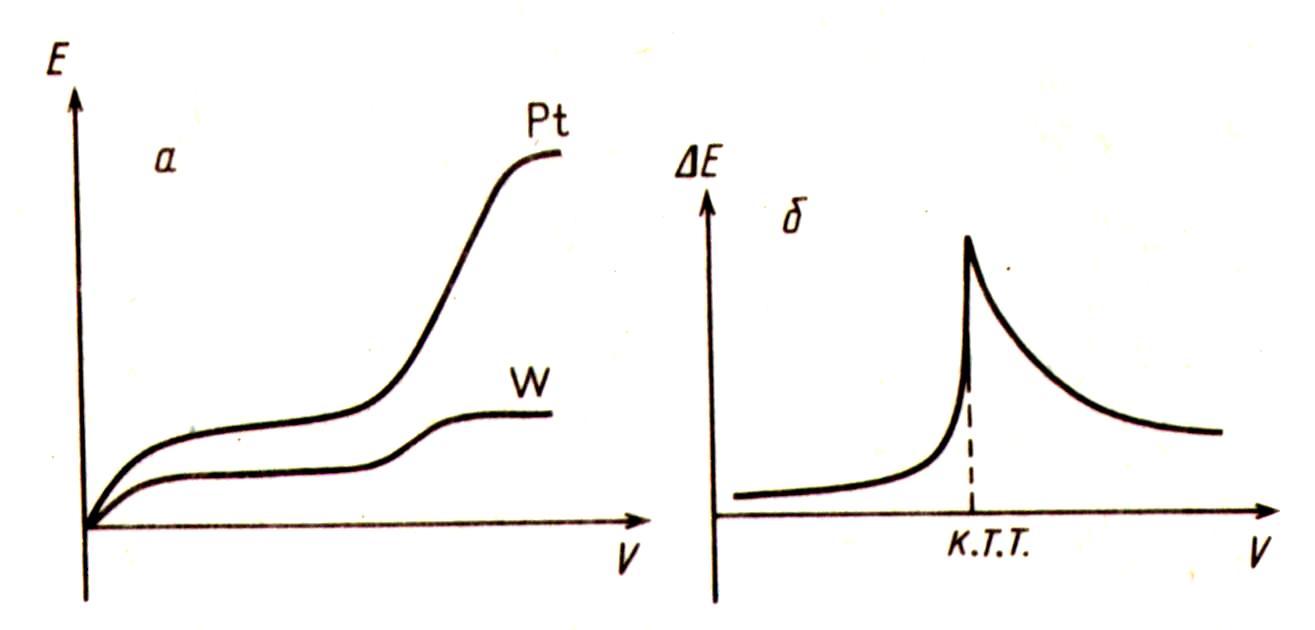
Рис. 2.18. Изменение потенциалов Pt и W электродов при титровании компонента (Fe2+) обратимой редокс системы раствором компонента (Cr2O7 ) необратимой редокс системы (а), и дифференциальная кривая титрования этих же компонентов с применением биметаллической пары электродов (Pt-W) (6)
В качестве таких электродов успешно могут быть использованы в ред-окс реакциях платина - углерод, платина - вольфрам, платина - родий, платина - палладий и др.
Если титруемое и титрующее вещества являются компонентами обратимых ред-окс систем, то изменение потенциала каждого электрода до т.э. одинаково, поэтому разность потенциалов Е между ними практически равна нулю. Как только концентрация титруемого вещества изменится настолько, что возникает смешанный потенциал, величина кторого существенно зависит от материал электрода, между электродами создается большая разность потенциалов, указывающая на достижение конечной точки. После точки эквивалентности с появлением другой обратимой ред-окс системы, к которой принадлежит титрант, потенциалы электродов снова становятся практически равными. Ход титрования изображается дифференциальной кривой.
В том случае, когда титруемое вещество является компонентом обратимой ред-окс системы, а титрующее - необратимой, до к.т.т. картина аналогична описанной выше, однако после резкого скачка потенциала Е остается значительной. В качестве примера на рис. 2.18 приведены изменения потенциалов Pt- и W-электродов в отдельности во время титрования Fe2+ бихромата и форма кривой титрования.
Потенциометрическое титрование при контролируемом токе (I0). При работе с необратимыми ред-окс системами потенциал электрода устанавливается медленно, он неустойчив, поэтому потенциометрическое титрование без тока (I=0) малопригодно. В этои случае успешно может быть использовано титрование под током (I=0).
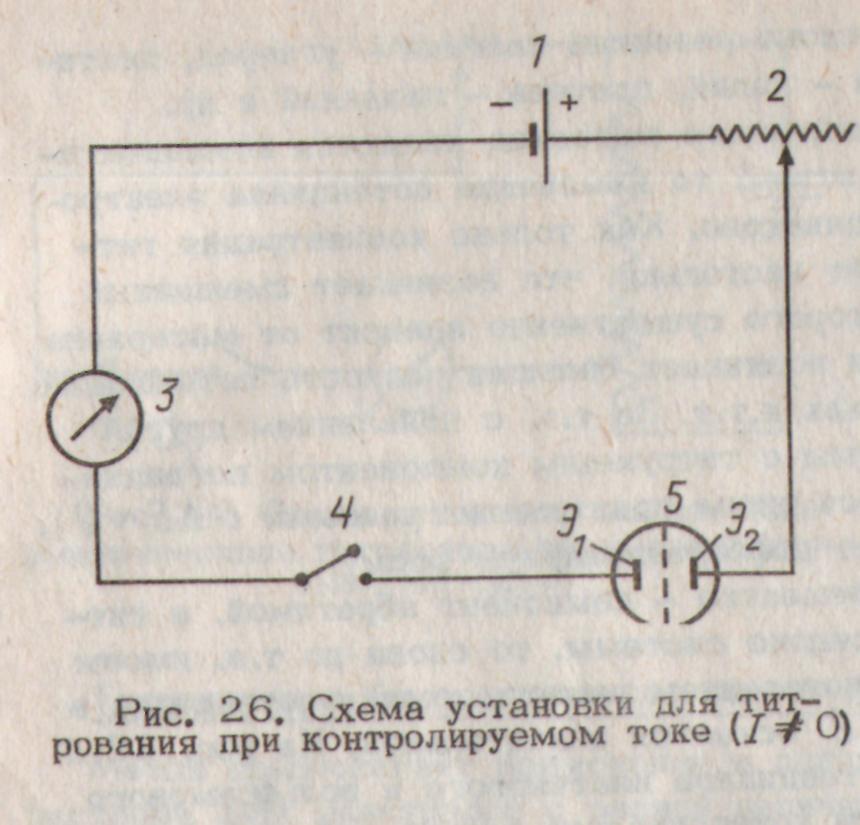
На рис. 2.19 изображена схема установки для работы с поляризованными электродами. От внешнего источника постоянного тока (1) с большим выходным напряжением при помощи переменного мегомного сопротивления (2) получают в цепи небольшой (n.10 мкА), но постоянной величины ток, измеряемый микроамперметром (3). В цепи также последовательно включены ключ (4) и электролитическая ячейка (5) с электродами Э1 и Э2, которые в свою очередь подключены к соответствующим клеммам потенциометра или цифрового вольтметра ( на рисунке не показаны).
|
Если в потенциометрической (электролитической) ячейке исполь-зуется один поляризуемый инди-каторный электрод и неполяризуемый значительно больший по площади полуэлемент сравнения (например, каломельный электрод), то первый можно поляризовать либо катодно, либо анодно в зависимости от характера проводимой химической |
Рис. 2.19. Схема установки для титрования при контролируемом токе (I≠0) |
реакции. При этом вследствие быстро-го обмена большим количеством |
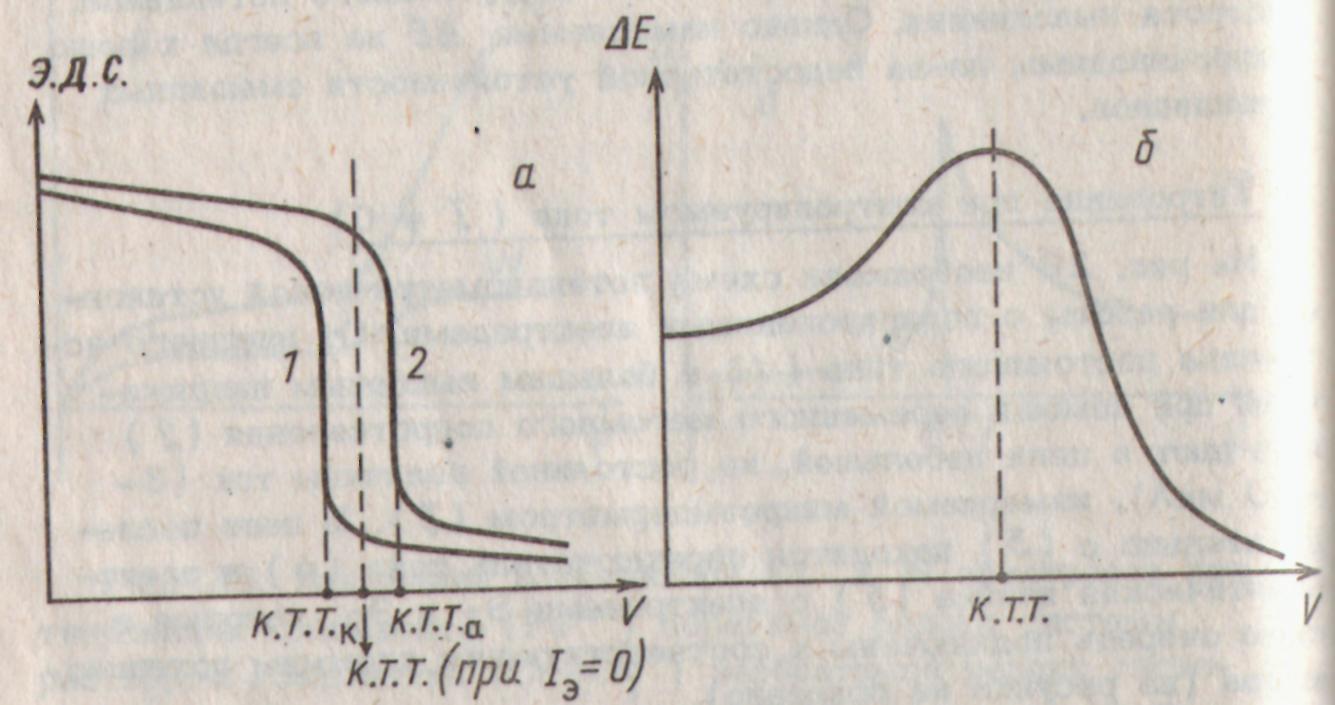
Рис. 2.20. Кривые титрования Ох1 раствором Red2 с одним поляризованным электродом (а): 1 - катодно, 2 - анодно; кривая титрования компонента необратимой редокс системы с двумя поляризованными электродами (б)
Чаще применяют два поляризуемых идентичных (из одного и того материала и одинакового размера) электрода в одном и том же титруемом растворе, один из которых выполняет роль катода, а другой - анода.
В растворе, содержащем обратимую редокс-систему, потенциал инертного электрода, практически равен равновесному потенциалу. При протекании небольшого электрического тока между двумя идентичными инертными электродами, погруженными в раствор с обратимой редокс-системой, между этими электродами возникает очень небольшая разность потенциаов. Однако если редок-система полностью необратима или если скорость ее реакции невелика, то разность потенциалов между электродами будет иметь большое значение.
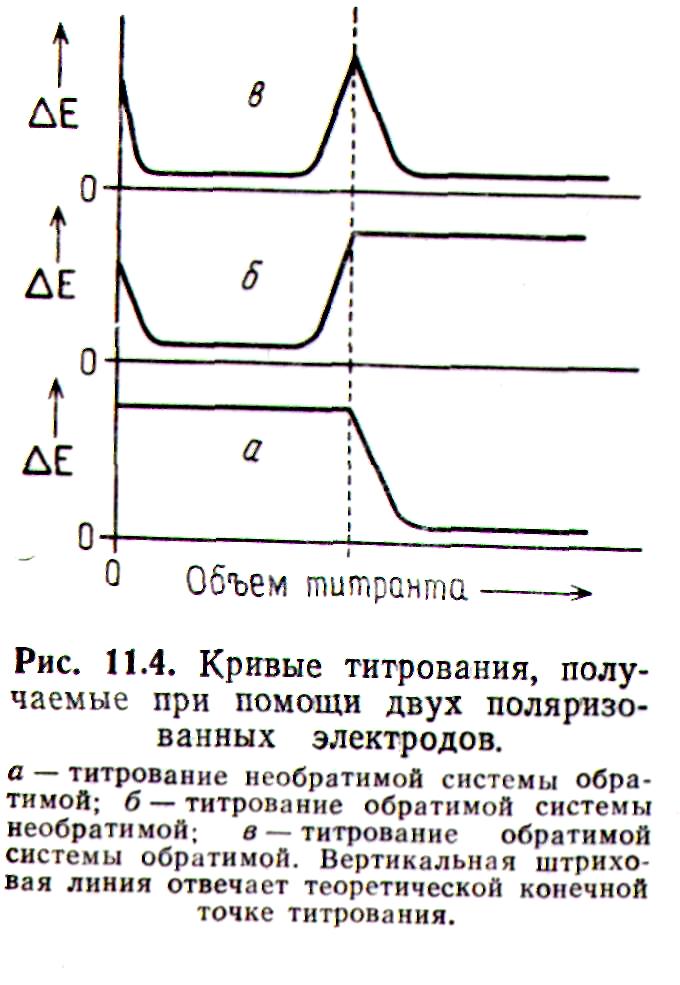
Форма кривых титрования с двумя поляризованными электродами определяется обратимостью, участвующих в реакции редокс-систем. Три типа кривых приведены на рис. 2.21.
|
При титровании необратимой редокс-системы обратимой редоке-сиетемой до достижения точки эквивалентности между электрода-ми, через которые протекает небольшой постоянный ток, наблюдается значительная разность потенциалов, поскольку добавляемая в раствор обратимая система удаляется в результате протекания стехиометрической реакции титрования. Разность потенциалов остается высокой до тех пор, пока в растворе не |
Рис. 2.21. Кривые титрования, получаемые при помощи двух поляризованных электродов. а − титрование необратимой системы обратимой; б − титрование обратимой системы необратимой; в − титрование обратимой системы обратимой. Вертикальная штриховая линия отвечает теоретической к.т.т. |
появится достаточная концентра-ция обратимой редокс-системы, что произойдет сразу после точки эквивалентности. Кривая титрова-ния для этого случая приведена на рис. 2.21, а. |
В то же время при титровании обратимой редокс-системы необратимой вначале, как правило, разность потенциалов между электродами уменьшается, так как обратимая система устанавливается на обоих электродах, поскольку в начале титрования в растворе присутствует либо только окисленная, либо только восстановленная форма обратимой редокс-системы, но не обе формы вместе. Далее, пока в растворе присутствует обратимая система, по ходу титрования наблюдается небольшая разность потенциалов, но непосредственно перед точкой эквивалентности концентрация обратимой системы резко уменьшается (практически до нуля) в результате реакции с необратимой редокс-системой, и разность потенциалов возрастает. Теперь все определяется необратимой системой, для которой характерным является поляризуемость электродов. Кривая для такого случая титрования показана на рис. 2.21,б.
Если обратимую систему титруют также обратимой системой, перед точкой эквивалентности кривая титрования имеет такую же форму, как и при титровании обратимой системы необратимой (что обсуждалось выше). Однако после прохождения точки эквивалентности разность потенциалов между электродами снова уменьшается, поскольку на обоих электродах устанавливаются потенциалы, определяемые второй обратимой редокс-системой. Кривая титрования для этого случая приведена на рис. 2.21,в. Важно ясно представлять, себе, что до и после точки эквивалентности электроды реагируют на различные редокс-системы. В то время как разность потенциалов между электродами невелика как до, так и после точки эквивалентности, абсолютные величины потенциалов электродов, измеренных относительно неполяризованного электрода сравнения, погруженного в тот же раствор, могут сильно измениться по сравнению с их первоначальным значением в исходном растворе.