- •1. Классификация электрохимических методов анализа
- •2. Потенциометрия
- •2.1. Потенциометрическое титрование
- •2.1.1. Индикаторные электроды, преимущества потенциометрической индикации конечной точки титрования
- •2.1.2. Кислотно-основное титрование
- •2.1.3. Потенциометрическое титрование в неводных средах
- •2.1.4. Индикация конечной точки потенциометрического титрования
- •2.2. Прямая потенциометрия. Ионометрия.
- •2.2.1. Ионоселективные мембранные электроды и их классификация
- •2.2.2. Ионоселективные электроды с твердыми мембранами
- •2.2.3. Электроды с жесткой матрицей. Стеклянный электрод
- •2.2.4. Ионоселективные электроды с жидкими мембранами
- •2.2.5. Газочувствительные электроды
- •2.2.6. Потенциометрические биосенсоры
- •2.2.7. Ионоселективные полевые транзисторы
- •2.2.8. Ионоселективные микроэлектроды
- •3. Электрогравиметрия и кулонометрия
- •3.1. Законы электролиза
- •3.2. Электрогравиометрический анализ
- •3.3. Кулонометрия
- •3.3.1. Классификация кулометрических методов
- •3.3.2. Прямая потенциостатическая кулонометрия
- •3.3.3. Прямая амперостатическая кулонометрия
- •3.3.4. Кулонометрическое титрование при постоянной силе тока
- •15.6. Электрогенерирование кулонометрических титрантов в неводных средах
3.3.4. Кулонометрическое титрование при постоянной силе тока
Амперостатический кулонометрический анализ можно проводить косвенным методом. Если определяемое вещество электрохимически не активно, то в раствор добавляют вещество, из которого электрохимически получают промежуточный продукт, который быстро и стехиометрически реагирует с определяемым веществом. Этот прием сходен с обычным титрометрическим определением, с той разницей, что титрант получают электрохимически в ходе анализа непосредственно в испытуемом растворе. Поэтому такой вариант называют кулонометрическим титрованием с внутренней генерацией титранта.
В тех случаях, когда продукт электрохимической реакции на вспомогательном электроде мешает определению анализируемого вещества или когда условия протекания электрохимической и химической реакций различаются, используется внешняя генерация титранта. Этот вариант применяют редко, т.к. он уступает по точности внутренней генерации, а также из-за неудобств, связанных с необходимостью смешивания подвергнутого электролизу раствора с анализируемым раствором.
Электрогенерация кулонометрических титрантов позволяет использовать неустойчивые реагенты, имеющие высокую реакционную способность. Это исключает необходимость их приготовления заранее, а также позволяет контролировать их концентрацию в растворе и проводить стандартизацию, что в итоге повышает точность определений.
Электролиз для получения электрогенерированного титранта необходимо проводить при 100 %-ном выходе по току реакции, протекающей на генераторном (рабочем) электроде. О количестве полученного титранта судят по количеству пошедшего на электролиз электричества, которое легко найти при неизменяющейся величине генераторного тока как произведение тока на время электролиза.
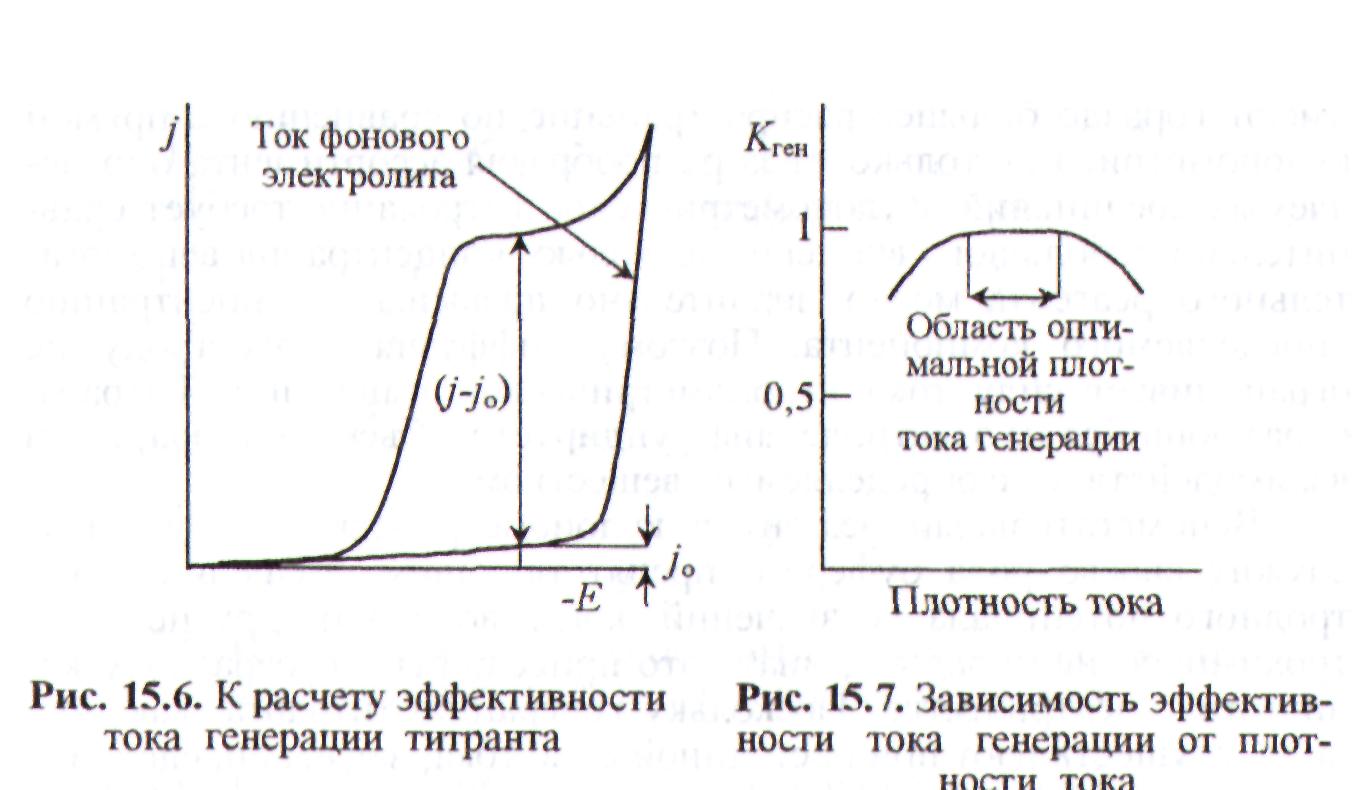
Для выбора оптимальных условий электролиза при электрогенерации титранта и получения сведений о характере электродного процесса используют вольтамперные кривые. По кривым поляризации находят значения плотности тока в отсутствие (i0) и в присутствии (i) вспомогательного реагента, из которого генерируется титрант, и вычисляют эффективность тока генерации титранта (Кген) при соответствующем потенциале по формуле
![]() .
(3.19)
.
(3.19)
На рис. 3.9 приведены поляризационные кривые и схема расчета Кген, Оптимальные условия обеспечения 100%-ной эффективности тока генерации находят из серии зависимостей Кген от плотности тока для различных концентраций вспомогательного реагента, состава фонового электролита, рН среды, температуры, материала электрода и др. Рисунок 10 иллюстрирует выбор условий для 100%-ной эффективности тока генерации.
|
|
Рис. 9. Поляризационные кривые для фонового электролита и фонового электролита с добавкой вспомогательного электролита |
Рис. 10. Зависимость эффективности тока генерации от плотности тока |
В найденных условиях проводят кулонометрическое титрование известных количеств определяемого вещества при различной плотности тока. Полученные данные используют для расчета другого параметра - эффективности кулонометрического титрования (Ктит). Этот параметр рассчитывают по количеству электричества, затраченного на кулонометрическое титрование известного количества определяемого вещества (Qэкс), и по Qтeop - теоретической величине, найденной для титрования того же количества определяемого вещества:
Ктит =Qтеор / Qэкс. (3.20)
При правильно выбранных условиях титрования значение Ктит равно 100%. Для устранения побочных реакций, понижающих Кген, следует применять фоновые электролиты и растворители, свободные от электроактивных примесей, а также создавать инертную атмосферу в ходе электролиза.
Источниками ошибок в кулонометрическом титровании могут быть изменение силы тока в ходе электролиза, отклонение процесса от 100%-ного выхода по току, ошибки в измерении силы тока и времени электролиза, индикаторная ошибка, обусловленная несовпадением точки эквивалентности и конечной точки титрования. При 100%-ном выходе по току и количественном протекании химической реакции титранта с определяемым веществом точность определения зависит от точности измерения тока генерации и времени электролиза, а также от способа обнаружения конечной точки титрования.
Если каким-либо способом зарегистрировать конечную точку титрования и соответствующие этому моменту время электролиза tэ, то по закону Фарадея можно рассчитать количество электрогенерированного за это время титранта и эквивалентное ему содержание определяемого вещества в растворе.
Почти все способы индикации конечной точки титрования (КТТ), используемые в титриметричеких методах анализа, пригодны и при кулонометрическом титровании. Применяются цветные индикаторы (в основном при кислотно-основных реакциях) и визуальная регистрация конца титрования. Наибольшее распространение в кулонометрическом титровании получили инструментальные методы: потенциометрия, амперометрия, фотометрия и спектрофотометрия. Из них наиболее часто используются потенциометрия и биамперометрия.
Конструкция ячейки для кулонометрического титрования сложнее, чем в случае электролиза при контролируемом потенциале, поскольку в ней необходимо разместить вспомогательные электроды для установления конечной точки титрования. Кроме того, в такой ячейке должны быть обеспечены разделение катодного и анодного пространств для предотвращения анодного окисления продуктов катодной реакции (и наоборот), а также тщательное перемешивание титруемого раствора и инертная атмосфера. С этой целью применяют пористые перегородки, которые изготавливают из керамики, асбеста, бумаги, ионообменных мембран и др. В отдельных случаях можно обойтись и без пористой перегородки между анодным и катодным пространствами. Такое случается, когда образуются либо газообразные продукты, либо продукты, выпадающие в осадок. Блок-схема установки для кулонометрического титрования приведена на рис. 3.11.
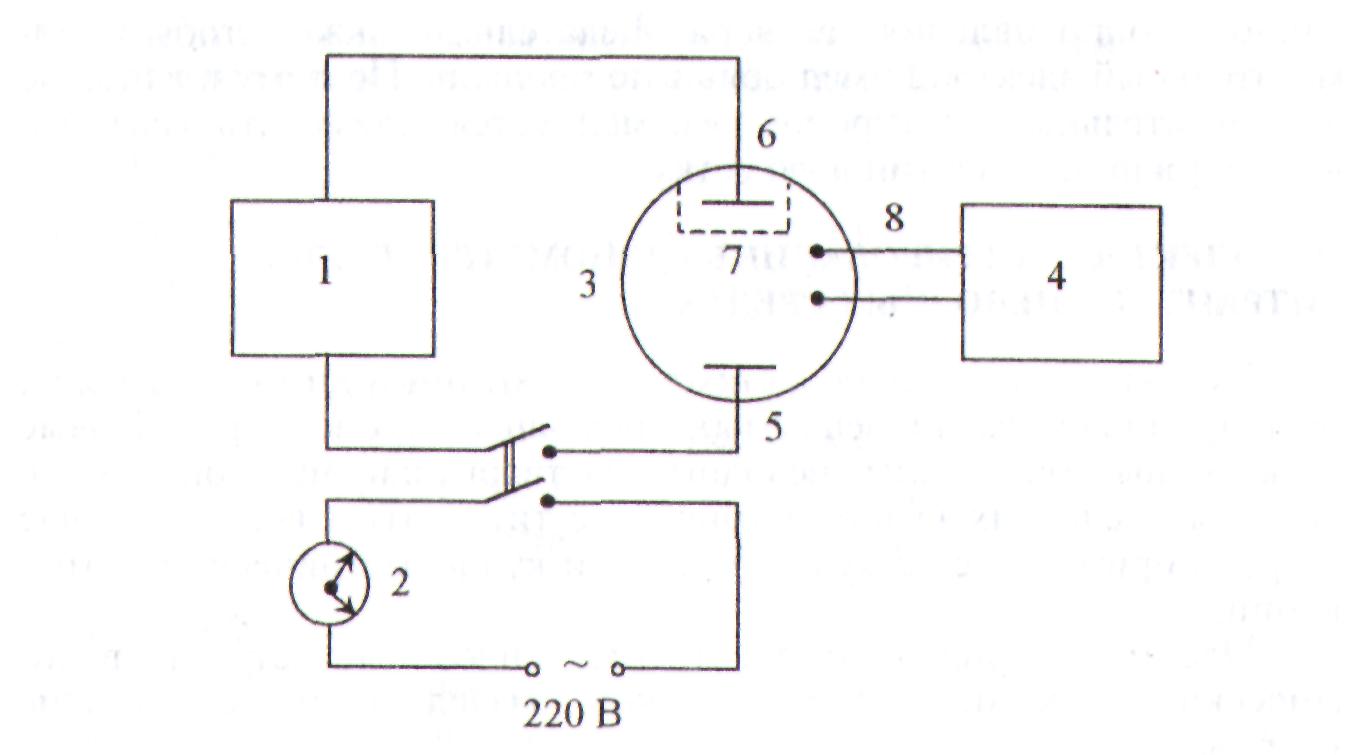
Рис. 3.11. Блок-схема установки для кулонометрического титрования
1 - источник постоянного тока (гальваностат); 2 - электронные часы; 3 - кулономегрическая ячейка; 4 - устройство для определения конечной точки титрования; 5 - генераторный электрод; 6 - вспомогательный электрод; 7 - пористая перегородка; 8 - электроды для установления конечной точки титрования
Для проведения определений при контролируемой силе тока применяют гальваностаты, работающие на операционных усилителях, которые позволяют проводить электролиз при токах от 10 до 200 мкА. В этом случае время титрования составляет 10-100 с.
Рабочие электроды для кулонометрии и кулонометрического титрования изготавливают из различных материалов. Часто они аналогичны электродам, применяемым в вольтамперометрии. Наиболее распространенным электродным материалом для электролиза при положительных потенциалах, несомненно, является платина. Электроды на основе металлической ртути обычно применяют для катодной генерации титранта в водной среде. В качестве вспомогательных электродов рекомендуется применять графитовые стержни или платиновую сетку с большой площадью.
В кулонометрическом титровании применяются все типы реакций: нейтрализации, окисления-восстановления, комплексообразования и осаждения.
Рассмотрим в качестве примера кулонометрическое титрование по методу окисления - восстановления при определении содержания тиосульфат-ионов. Прямое кулонометрическое их определение анодным окислением невозможно, так как данная реакция в водной среде сопровождается выделением кислорода и идет с выходом по току менее 100 %.
Тиосульфат-ион в обычном объемном анализе титруют раствором иода по реакции
2S2O32- + J2 = S4O62- + 2J- ,
используя в качестве индикатора крахмал или регистрируя к.т.т. потенциометрически. Анализ с использованием данной реакции можно провести также кулонометрически, если в исследуемый раствор ввести избыток KJ, фоновый электролит, погрузить два платиновых электрода и вести электролиз при постоянной силе тока. На аноде (генераторном электроде), согласно электрохимической реакции
2.J- - 2e- = J2 ,
будет генерироваться титрант, который тут же вступает во взаимодействие с тиосульфат-ионом.
Время конца титрования tэ можно зарегистрировать визуально в момент появления синей окраски раствора в присутствии крахмала. Более объективно и точно это время будет установлено, если измерять в ходе электролиза оптическую плотность раствора. Для этого в качестве электрохимической ячейки используется кювета фотоколориметра. Конечной точке титрования отвечает излом на кривой изменения оптической плотности раствора.
Для окислительно-восстановительных реакций наиболее удобными способами определения времени завершения титрования tэ являются потенциометрический и биамперометрический.
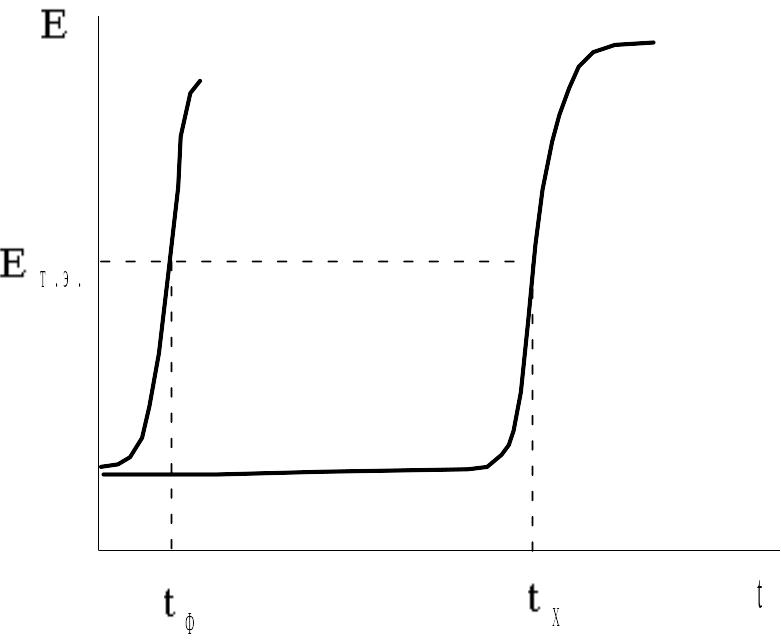
Если в испытуемый раствор погрузить индикаторный Pt-электрод и хлорсеребряный электрод сравнения и измерять в ходе титрования ЭДС данного гальванического элемента Е с помощью потенциометра или цифрового вольтметра, то получим кривую, представленную на рис. 3.12. Время конца титрования tэ отвечает моменту, когда Е=ЕТЭ. Чтобы внести поправку на присутствие в фоновом электролите способных к окислению генерированным иодом примесей, титруют также определенный объем фона без добавления анализируемого раствора тиосульфата.
|
|
Рис. 3.12. Изменение ЭДС индикаторной системы в ходе кулонометрического титрования фонового электролита без добавки и с добавкой тиосульфат-иона
|
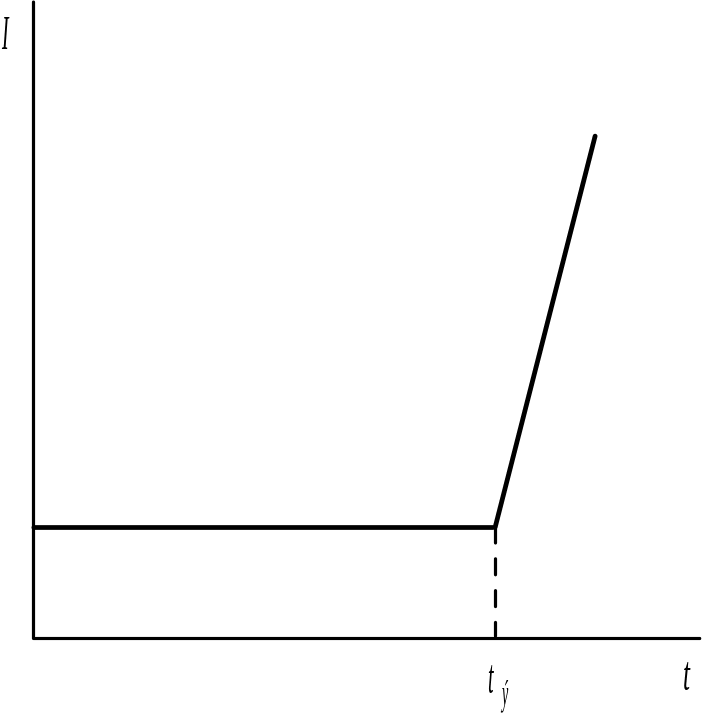
Рис. 3.13. Изменение тока при биамперометрической индикации конца кулонометрического титрования тио-сульфат-иона электрогенерированным I2
|
Концентрация анализируемого раствора рассчитывается по формуле:
![]() мг-экв/л,
(3.21)
мг-экв/л,
(3.21)
где I – величина генераторного тока, при котором ведется титрование, мА; tx – время, затраченное на титрование анализируемого раствора, с; tф – время, затраченное на титрование фона, с; Vx – объём пробы анализируемого раствора, мл.
При амперометрической индикации tэ очень часто пользуются биамперометрической системой - с двумя поляризованными электродами. Для рассматриваемой окислительно-восстановительной реакции в качестве индикаторных электродов можно использовать два одинаковых по площади платиновых электрода, подключенных к поляризующей схеме. На Pt-электроды с помощью источника постоянного напряжения (1) и потенциометра (2) подается небольшая (несколько милливольт) разность потенциалов Е, которая контролируется вольтметром (3). Если индикаторные электроды находятся в растворе, не содержащем веществ, которые способны окисляться и восстанавливаться на индикаторных электродах при заданном значении Е, то регистрируемый микроамперметром (4) ток в индикаторной цепи I=0.
В рассматриваемом примере окилительно-восстановительная система 2.S2O32- - 2e- S4O62- является необратимой (т.е. в водной среде невозможно окисление на аноде тиосульфат-иона в тетратионат-ион при незначительной поляризации анода), а система 2I- - 2e- = I2 - обратимая. До момента эквивалентности, пока в растворе практически отсутствует I2, способный к восстановлению при незначительной поляризации катода, ток в измерительной цепи I будет приблизительно равен нулю. После того как весь тиосульфат будет оттитрован, в растворе начнет увеличиваться концентрация I2, соответственно будет возрастать и величина измеряемого тока I. Кривая кулонометрического титрования I=f(t) для данной реакции имеет резкий излом, отвечающий времени tэ.
Кулонометрическое титрование, основанное на окислительно-восстановительных реакциях, широко распространенный электрохимический метод анализа. В литературе приводится значительное число методик с использованием электрогенерируемых окислителей: Mn(VII), Fe(III), Cr(VI), V(VI), Mo(V), Ce(IV), [Fe(CN)6]3-, I2, Br2, Cl2 и некоторых других. Электрохимически может быть генерирован (в растворе AgNO3 0,1 M и HNO3 0,5 M при 5 оС) и использован в анализе самый сильный и самый неустойчивый окислитель Ag(II). Наиболее часто в анализах применяются электрогенерированные титранты - восстановители: Cu(I), Sn(II), Cr(II), Fe(II), Ti(II), V(IV).
Кулонометрическое определение кислот основано на генерировании гидроксид-ионов при электролизе воды. На катоде происходит восстановление воды
![]() ,
,
а на аноде ее окисление
![]() .
.
Чтобы не допустить случайного попадания
ионов
![]() из анодного пространства в рабочий
объём, применяются ячейки с внешней
генерацией
из анодного пространства в рабочий
объём, применяются ячейки с внешней
генерацией
![]() ,
когда титрант генерируется в отдельной
камере и затем добавляется к анализируемому
веществу.
,
когда титрант генерируется в отдельной
камере и затем добавляется к анализируемому
веществу.