
- •Учебное пособие Санкт-Петербург
- •Глава 1. Химический и технологический принципы
- •Глава 2. Оценка эффективности химического
- •Глава 3. Экологические проблемы химической
- •Введение
- •Глава I. Химический и технологический принципы
- •Химическая схема производства
- •1.3. Технологическая схема производства
- •Глава 2. Оценка эффективности химического
- •Эффективность химического производства и уровень совершенства химико-технологического процесса можно оценить по целому ряду показателей.
- •2.2. Экологичность и безопасность производства
- •2.3. Социологические критерии
- •2.4. Качество функционирования производства
- •2.6. Энергетическая эффективность производства
- •2.7. Эксергетический метод оценки эффективности
- •А на выходе из системы
- •И изменение эксергии в ходе процесса
- •Это уравнение носит название уравнения Гюи—Стодолы.
- •Понятие анергии помогает осознать тот факт, что объективно существует такая энергия, которая в принципе неработоспособна, и попытки организовать процесс, основанный на ее использовании, бесполезны.
- •Глава 3. Экологические проблемы химической
- •3.1. Химическое производство и загрязнение природы
- •3.2. Безотходная технология
- •Основная литература
2.6. Энергетическая эффективность производства
Есть группа показателей, которые характеризуют э н е р г е т и ч е с -
к у ю э ф ф е к т и в н о с т ь производства. Для оценки энергетической эффективности химико-технологических процессов необходимо знание законов термодинамики. Термодинамический анализ основан на рассмотрении ограниченного числа характеристик, влияющих на энергетическую и экономическую эффективность технологических схем. Такой анализ позволяет на ранней стадии исследования предвидеть экономическую целесообразность или бесперспективность тех или иных предложений.
При
разработке технологического процесса
прежде всего в первую очередь необходимо
установить какие реакции будут протекать
при переработки выбранного сырья и
насколько глубоко будет проходить
основная химическая реакция, т.е. та
реакция, которая обеспечивает получение
заданного продукта (т.е. нам необходимо
установить каков будет максимальный
выход целевого продукта). Представления
о том, насколько глубоко может протекать
химическая реакция, можно получить на
основании данных о равновесии этой
реакции. Термодинамический расчет дает
нам возможность установить связь между
концентрациями исходных веществ и
продуктов реакции – это можно сделать
с помощью вычисления значений константы
равновесия химической реакции. Для
этого нужно рассчитать изменение энергии
Гиббса во время реакции и из уравнения
![]() найти константу равновесия.
найти константу равновесия.
Расчеты константы равновесия и изменения энергии Гиббса играют важную роль в оценке химической достоверности нового метода (нового процесса), потому что дают возможность определить максимально возможное количество целевого продукта. Отрицательный итог расчета заставляет нас отказаться от рассматриваемого процесса (рассматриваемого метода) или же заставляет искать новый способ проведения химического превращения. Однако и положительный результат расчета еще не гарантирует возможность использования предложенного метода (скорость реакции может быть очень малой для промышленных целей). Но положительный результат может указать на то, что нужно провести соответствующий поиск (например, отыскать катализатор, ускоряющий превращение и т. п.).
Для наиболее полного использования сырья необходимо вести техноло-гический процесс в таких условиях, чтобы получить наиболее высокую степень превращения исходных веществ. Поэтому большой практический интерес имеет выяснение влияния различных факторов на равновесие системы (а также разработка приемов, позволяющих сдвигать равновесие в сторону образования целевых продуктов).
Основные параметры, влияющие на равновесие химической реакции – температура, давление, концентрации реагирующих веществ. Эти параметры обычно и используются на практике для сдвига равновесия в желаемую сторону, т.е. для регулирования равновесной степени превращения.
Напомним – качественно влияние основных параметров технологи-ческого режима на равновесие в гомогенных и гетерогенных системах определяется принципом Ле-Шателье: в системе, выведенной внешним воздействием из состояния равновесия, происходят изменения, направленные к ослаблению воздействий, выводящих систему из равновесия.
Мы не будем здесь подробно говорить об этом принципе (это все вы прекрасно должны помнить из курса физической химии), но здесь можно напомнить выходящие из него выводы, а именно:
при повышении температуры равновесие смещается в сторону получения
целевых продуктов (
 )
для реакций А
)
для реакций А B
– Q
B
– Qисходных реагентов (
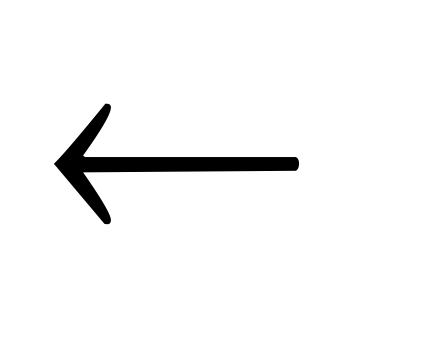 )
для реакций A
B
+ Q
)
для реакций A
B
+ Q
при повышении давления равновесие смещается в сторону получения
целевых продуктов ( ) при
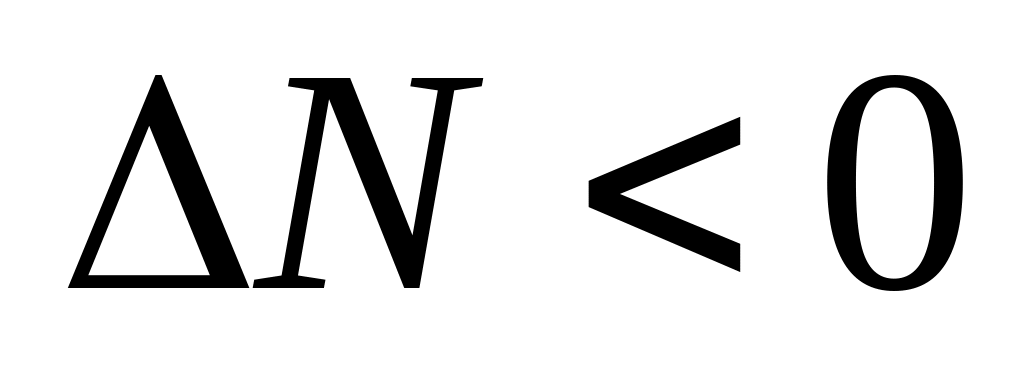 (при
уменьшении V)
(при
уменьшении V)исходных реагентов ( ) при
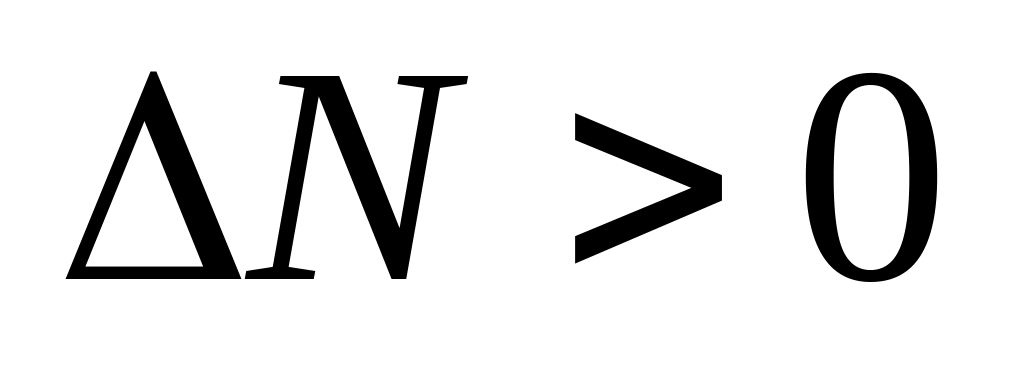 (при
увеличении V)
(при
увеличении V)не изменяется ( ) при
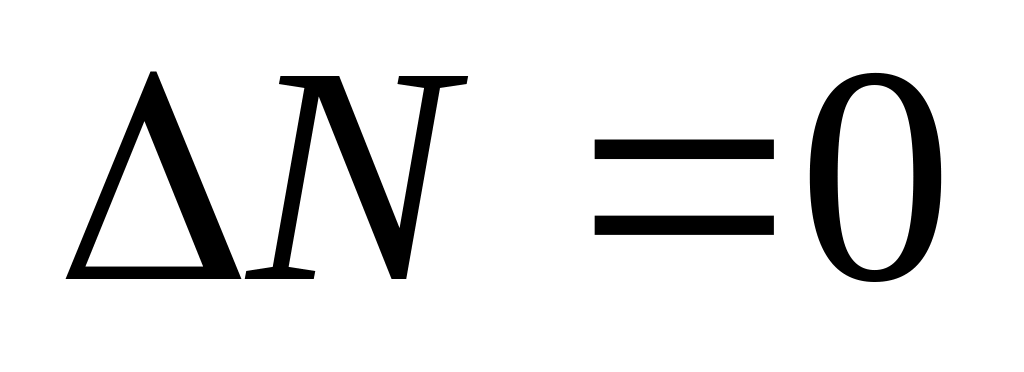 (при
V = const)
(при
V = const)
при повышении концентрации исходных реагентов равновесие смещается в сторону образования целевых продуктов ( ).
Константа
равновесия тесно связана с равновесной
степенью превра-щения:
![]() ,
но вид этой зависимости будет определяться
типом химической реакции, и, в принципе,
можно получить уравнения, связывающие
равновесную степень превращения и
константу равновесия для любой обратимой
реакции. Например, для простой обратимой
реакции А
,
но вид этой зависимости будет определяться
типом химической реакции, и, в принципе,
можно получить уравнения, связывающие
равновесную степень превращения и
константу равновесия для любой обратимой
реакции. Например, для простой обратимой
реакции А![]() В
она будет
В
она будет
![]() , для реакции A
2B
будет:
, для реакции A
2B
будет:
![]() ,
где Р – общее давление. Для газовой
реакции А+В
D
константа равновесия и степень превращения
связаны такой зависимостью:
,
где Р – общее давление. Для газовой
реакции А+В
D
константа равновесия и степень превращения
связаны такой зависимостью:
![]() ;
для газовой реакции типа А+В
2D
зависимость будет такая:
;
для газовой реакции типа А+В
2D
зависимость будет такая:
![]() .
.
В современных комплексных многостадийных химических производствах применяются энерготехнологические схемы, в которых на многих стадиях используются продукты и вторичная энергия, произведенные на других стадиях. Так, в производстве аммиака в качестве теплоносителя для регенерации абсорбента при очистке газа от СО2 используется парогазовая смесь после конверсии оксида углерода. Аналогично для конверсии СО водяным паром используется пар, введенный в газовую смесь ранее — на стадии конверсии метана при более высокой температуре. Далее, на компрессию газа для синтеза аммиака при 30 МПа поступает газ при давлении 2,5 МПа, который сам непосредственно не подвергался компрессии, а был получен при конверсии метана под давлением. В подобных случаях оценить денежную стоимость энергоносителя трудно. Поэтому особую важность приобретают натуральные показатели (удельный расход тепла на 1 т продукта, удельный расход электроэнергии и т. п.). Однако число этих показателей чаще всего велико (в соответствии с числом потребляемых видов сырья и энергии), нередко эти показатели противоречивы (в одном процессе велик расход электроэнергии и низок расход пара, в другом — возможна обратная картина). Это затрудняет или делает невозможным сравнение процессов.
Даже в простейшем случае, когда производится один вид продукции и тратится один вид энергии, размер удельных затрат не полностью характеризует степень совершенства процесса. Так, в одном из методов производства аммиака затрачивается только природный газ, и расходный коэффициент метана на 1 т аммиака является важнейшим показателем для сравнения как уровня техники, так и уровня эксплуатации на различных заводах. Однако знание только этой величины без дополнительного термодинамического анализа не позволяет оценить, каковы возможности ее снижения.
В тех случаях, когда в процессе потребляется несколько видов энергии, но производится один продукт, для сопоставления его с другими процессами используют так называемый удельный расход энергии на единицу продукта, определяемый на основе энергетического баланса
эу=∑э/п.
При расчете удельного расхода суммируют все виды энергетических затрат независимо от их характера и качества. Недостатки такого критерия сводятся к следующему:
1. При суммировании различных видов энергии не учитывается их качество, т. е. способность производить полезную работу.
2. Невозможно объективно учесть вторичные энергетические ресурсы. Лю-бая попытка сделать это приводит либо к завышению, либо к занижению истинного расхода энергоресурсов, и при расчете на основе только энергетического баланса результат заведомо не может быть правильным. Если сумму вторичных энергетических ресурсов (ВЭР) вычитают из суммы первичных энергозатрат, то занижают энергетические затраты. Так, в стремлении доказать «малую энергоемкость» какого-либо процесса производства аммиака из суммы подведенной к системе энергии (с природным газом) вычитают сумму ВЭР (горячая вода, пар) и получают якобы весьма низкий расходный коэффициент в ГДж/т NH3, что вводит в заблуждение исследователей. Если же вторичные энергоресурсы вообще не учитывают, то истинные энергозатраты получаются завышенными.
3. Невозможно правильно распределить затраты энергии на различные продукты при комплексном их производстве.
Поэтому
широко распространен способ оценки
степени совершенства через
«тепловой», или «термический» КПД.
Значение
энергетического КПД:
![]()
где
![]() - сумма полезно затраченных энергий;
- сумма полезно затраченных энергий;
![]() -
сумма общих затрат энергии.
-
сумма общих затрат энергии.
