
- •Учебное пособие Санкт-Петербург
- •Глава 1. Химический и технологический принципы
- •Глава 2. Оценка эффективности химического
- •Глава 3. Экологические проблемы химической
- •Введение
- •Глава I. Химический и технологический принципы
- •Химическая схема производства
- •1.3. Технологическая схема производства
- •Глава 2. Оценка эффективности химического
- •Эффективность химического производства и уровень совершенства химико-технологического процесса можно оценить по целому ряду показателей.
- •2.2. Экологичность и безопасность производства
- •2.3. Социологические критерии
- •2.4. Качество функционирования производства
- •2.6. Энергетическая эффективность производства
- •2.7. Эксергетический метод оценки эффективности
- •А на выходе из системы
- •И изменение эксергии в ходе процесса
- •Это уравнение носит название уравнения Гюи—Стодолы.
- •Понятие анергии помогает осознать тот факт, что объективно существует такая энергия, которая в принципе неработоспособна, и попытки организовать процесс, основанный на ее использовании, бесполезны.
- •Глава 3. Экологические проблемы химической
- •3.1. Химическое производство и загрязнение природы
- •3.2. Безотходная технология
- •Основная литература
2.3. Социологические критерии
Существует группа с о ц и о л о г и ч е с к и х и с о ц и а л ь н о –
п с и х о л о г и ч е с к и х показателей, которые характеризуют комфортность обслуживания системы, условия работы на рабочих местах, престижность работы и т.д. Этой группе критериев оценки придается очень большое значение в зарубежной промышленной практике и, к сожалению, весьма малое – у нас. А между тем на этот вопрос следует обратить особое внимание, т.к. именно от этих показателей зависит текучесть рабочей силы, а следовательно, квалификация работающих, дисциплина производства и качество продукции.
2.4. Качество функционирования производства
Есть группа показателей, которая оценивает к а ч е с т в о ф у н к ц и --о н и р о в а н и я производства, точнее говоря, качество функциониро-вания системы, потому что химическое производство можно рассматри-вать (с точки зрения теории систем) как сложную химико-технологичес-кую систему (ХТС). Это такие показатели: устойчивость работы, чувствительность и надежность системы, ее управляемость и др. Эти показатели являются важнейшими характеристиками, поэтому мы их рассмотрим более внимательно.
Устойчивость системы – способность системы возвращаться в исходное состояние после устранения причин, которые вывели ее из этого установившегося (стационарного) состояния. Иначе говоря, это способность системы сохранять требуемые характеристические свойства в условиях действующих возмущений. Интенсификация процесса может привести к тому, что отдельные элементы системы будут работать в предельных режимах с максимальными показателями. Тогда возможно нарушение устойчивости и система начинает работать в неустойчивом режиме. Неустойчивый режим функционирования системы – крайне нежелательное явление, ликвидировать его можно введением дополнительных технологических связей и дополнительных воздействий. Устойчивость ХТС связана с другим ее качеством – надежностью.
Надежность системы – это ее свойство сохранять работоспособность в течение заданного времени функционирования. Высокая эксплуатационная надежность должна быть предусмотрена уже при проектировании, а затем должна быть обеспечена высоким качеством оборудования, а также систем контроля и управления. Надежность всего производства может быть обеспечена только на основе глубокого знания процессов, протекающих в нем.
Чувствительность
системы – это
способность системы реагировать на
внешние и внутренние воздействия,
изменяя параметры своего состояния,
т.е. характеристики своего функционирования.
Переменная чувствительность равна
отношению производной i-
той выходной величины по j-тому
входному параметру:
![]() .
Чем больше Pi
j, тем
сильнее влияет данный фактор на выход,
а если Pi
j мала,
то этим фактором нельзя пользоваться
как управляющим: он почти не влияет на
процесс. Если же чувствительность
чрезвычайно велика, то процесс становится
трудноуправляемым, т.к. слишком
чувствительная система обычно неустойчива
в работе и сложна в управлении.
.
Чем больше Pi
j, тем
сильнее влияет данный фактор на выход,
а если Pi
j мала,
то этим фактором нельзя пользоваться
как управляющим: он почти не влияет на
процесс. Если же чувствительность
чрезвычайно велика, то процесс становится
трудноуправляемым, т.к. слишком
чувствительная система обычно неустойчива
в работе и сложна в управлении.
Помехозащищенность – это свойство системы эффективно функционировать в условиях действия внутренних и внешних помех. К внутренним помехам можно отнести, например, изменение температуры или давления, а также активности катализатора (т.е. изменение некоторых параметров технологического режима), а к внешним – изменение атмосферных условий, расхода и состава сырья, нарушение режимов поставки сырья, отгрузки готовой продукции и проч. Помехи приводят к изменению параметров и свойств ХТС, и, следовательно, к ухудшению эффективности функционирования системы. Надо помехи обнаружить, выявить их и учитывать характер их действия.
Управляемость системы – способность системы достигать цели управления. Конечная цель управления – это выпуск запланированного количества продукции заданного качества, а это достигается поддерживанием параметров процесса на оптимальном уровне. Для обеспечения хорошей управляемости системы проектирование ее необходимо осуществлять совместно и параллельно с системой управления.
Эмерджентность – это свойство сложных систем, которое заключается в несводимости свойств системы в целом к свойствам составляющих ее подсистем (или элементов). Иначе говоря, это способность системы приобретать новые свойства, которые отличаются от свойств отдельных элементов, образующих эту систему. Эмерджентность – это новые качества, присущие системе и отсутствующие у любого из ее элементов. В частности, например, если в целом ХТС обеспечивает выпуск товарной продукции, в то же время ни один из элементов этой системы, взятых в отдельности, не может выполнить этой задачи.
Интерэктность – это качество, в некотором смысле, противоположное эмерджентности. Элементы, образующие ХТС, взаимосвязаны и влияют друг на друга. Благодаря этому влиянию, у них могут появляться новые свойства. Интерэктность – новые качества элементов системы, которые проявляются только при их работе в системе и отсутствуют при работе вне системы.
Все выше перечисленные критерии оценки эффективности производства наиболее пригодны для оценки производства в целом, а для более детального рассмотрения внутренней сущности химического процесса, оценки эффективности отдельных его этапов необходимо использовать такие показатели, которые отражали бы внутренние закономерности химического превращения, позволяли бы прогнозировать его результат, указывали бы пути совершенствования технологии. Такими количественными оценками совершенства процесса могут быть технологические критерии эффективности химико-технологического процесса.
2.5. ТЕХНОЛОГИЧЕСКИЕ КРИТЕРИИ ЭФФЕКТИВНОСТИ ХИМИКО-
ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА
Эти критерии с разных сторон характеризуют полноту использования возможностей осуществления конкретной химической реакции. К таким критериям относятся: производительность и интенсивность, степень превращения исходных веществ, расходные коэффициенты, выход продукта реакции, скорость превращения, селективность процесса. Эти показатели являются наиболее удобными для характеристики эффективности именно химических процессов, поэтому мы рассмотрим их несколько подробнее.
Производительность
и интенсивность работы.
Производительность определяется
количеством выработанного продукта
или переработанного сырья в единицу
времени: P
= G/![]() ,
где Р – производительность, G
- количество продукта,
-
время.
Производительность измеряется в кг/час,
т/сутки, м3/сутки.
,
где Р – производительность, G
- количество продукта,
-
время.
Производительность измеряется в кг/час,
т/сутки, м3/сутки.
Чтобы повышать производительность экономически эффективно все время увеличивать размер (и, следовательно, мощность) вновь устанав-ливаемых машин и аппаратов. Но, однако, увеличивать объем аппарата без значительного усложнения его конструкции возможно только до некоторого предела (в ряде крупномасштабных производств – аммиачных, сернокислотных – уже достигнут такой предел).
Химические отрасли промышленности сейчас располагают агрегатами оптимальной единичной мощности. Это установки для производства аммиака, серной кислоты, аммиачной селитры мощностью 400-450 тыс.т/г, полиэтилена (100 тыс.т/г) и др. Эти установки по своим технико-экономическим показателям не уступают лучшим зарубежным аналогам (т.е. находятся на уровне мировых стандартов).
Но с усложнением конструкции одновременно затрудняется обслужи-вание крупных аппаратов, поэтому значительно эффективнее повышать производительность аппаратов за счет интенсификации их работы.
Для сравнения работы различных аппаратов, в которых протекают одни и те же химические процессы, используют понятие интенсивности. Интенсивность – производительность, отнесенная к какой-либо величине, характеризующей работу аппарата (обычно относят к площади или объему аппарата) I =P/V = G/V , V – объем аппарата, поэтому P=IV. Следовательно, повышение производительности работы аппарата может быть достигнуто увеличением его размера или интенсивности работы.
Интенсификация работы оборудования обычно достигается либо улучшением конструкции аппаратов, либо совершенствованием технологи-ческих процессов в аппаратах данного вида. Так как интенсивность работы аппарата пропорциональна скорости процесса, то поэтому, изучая кинетику технологических процессов, стремятся создать такую конструкцию аппарата (и такой технологический режим в нем), который обеспечивал бы максимальную скорость процесса. Но интенсификация целесообразна лишь при условии, если она не вызывает большого роста затрат энергии на проведение процесса.
Степень превращения веществ – это доля исходного реагента, использованного на химическую реакцию. Таким образом, степень превращения показывает, насколько полно исходное сырье вступает в химическое превращение. Но показатель этот, однако, ничего не говорит о том, в какие продукты (целевые или побочные) превращается исходное сырье.
Степень превращения (Х) реагента (i) определяется по уравнению:
Xi
=![]()
где ni,0 - количество реагента i в исходной реакционной массе (в нулевой момент времени); ni – количество реагента i в рассматриваемый момент времени.
Обычно в химической реакции участвует не один, а два или несколько реагентов. Степень превращения может быть рассчитана по любому из этих реагентов, и в общем случае их степени превращения не будут совпадать, т.к., во-первых, в уравнении реакции реагенты находятся с разными стехиометрическими коэффициентами, а, во-вторых, как правило, они загружаются в аппарат в соотношении, не совпадающем с соотношением стехиометрических коэффициентов.
В соответствии со стехиометрическим уравнением простой реакции
aA
+ bB![]() rR
+ sS,
изменение
количества участвующих в превращении
веществ связаны соотношением:
rR
+ sS,
изменение
количества участвующих в превращении
веществ связаны соотношением:
![]() .
.
Степени превращения реагентов А и В определяются по формулам:
![]()
![]()
![]()
или
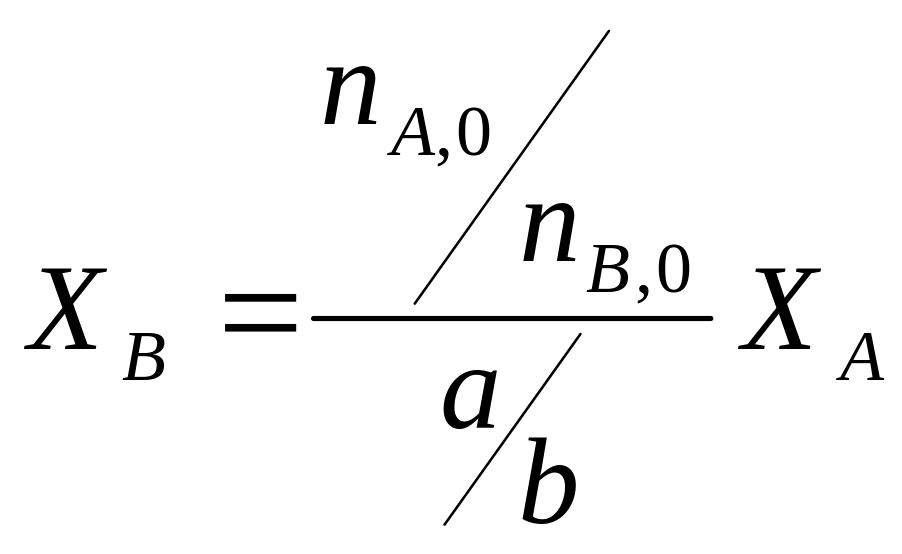
Таким
образом, последнее уравнение устанавливает
связь между степенями превращения
реагентов, участвующих в реакции. Из
этого уравнения видно, что если реагенты
загружены в стехиометрическом соотношении,
т.е.
![]() ,
то степени их превращения в любой момент
времени будут равны (ХА
= ХВ).
Но все это справедливо только при
протекании одной реакции.
,
то степени их превращения в любой момент
времени будут равны (ХА
= ХВ).
Но все это справедливо только при
протекании одной реакции.
Если
же реагент А взят в избытке, т.е.
![]() ,
то ХА<
ХВ.
И наоборот, если реагент В взят в избытке,
т.е.
,
то ХА<
ХВ.
И наоборот, если реагент В взят в избытке,
т.е.
![]() ,
то ХА >
ХВ.
,
то ХА >
ХВ.
Так как степень превращения – это доля первоначального количества реагента, то 0 < X < 1, и степень превращения реагента, взятого в избытке, всегда меньше единицы. Обычно в избытке берут более дешевый реагент, а сам избыток необходим для увеличения скорости превращения и достижения высокой степени превращения более дорогого сырья. Поэтому расчет степени превращения по реагенту, взятому в избытке, не характеризует глубину прохождения реакции. В связи с этим степень превращения принято рассчитывать по основному реагенту, из которого образуется продукт реакции.
Расходный коэффициент – это отношение количества сырья, затрачен-ного при проведении ХТП, к количеству полученного целевого продукта; он характеризует затраты сырья на производство. Различают теоретические и практические расходные коэффициенты. Теоретический расходный коэффициент рассчитывают по стехиометрическому уравнению основной реакции с учетом содержания исходного реагента в сырье. При расчете практических расходных коэффициентов необходимо учитывать степень превращения исходного реагента, выход продукта, избирательность реакции. Поэтому практический расходный коэффициент всегда выше теоретического, и чтобы его понизить необходимо повышать степень превращения, избирательность и выход продукта.
Для
простой необратимой реакции
![]() практический расходный коэффициент
для получения продукта В будет выражаться
уравнением:
практический расходный коэффициент
для получения продукта В будет выражаться
уравнением:
![]() ,
,
здесь
![]() -
степень превращения,
-
степень превращения,
![]() -
избирательность,
-
избирательность,
![]() -
выход про-дукта.
-
выход про-дукта.
Выход продукта. Степень превращения характеризует эффективность проведения процесса с точки зрения использования исходного сырья. Если процесс не осложнен побочными реакциями, то степень превращения сырья однозначно характеризует количество образовавшегося целевого продукта. Но, однако, в химической технологии очень мало несложных процессов. Значительно больше сложных процессов, в которых сырье превращается не только в целевой, но и в побочные продукты. Поэтому пользуются еще одним критерием эффективности процесса – выходом продукта.
Выход продукта – это отношение реально полученного количества продукта к максимально возможному его количеству, которое могло бы быть получено при данных условиях осуществления химической реакции.
Обозначим
выход продукта через G,
тогда для простой необратимой реакции
![]() имеем
имеем
![]()
Однако
в данном случае
![]() ,
а
,
а
![]() ,
поэтому для необратимых процессов
,
поэтому для необратимых процессов
![]()
т.е. в тех случаях, когда процесс описывается одной необратимой реак-цией, степень превращения основного реагента равна выходу продукта реакции. В реальных процессах выход целевого продукта ниже степени превращения реагента, и выразить GR через степень превращения и начальное количество вещества А нельзя, т.к. вещество А расходуется не только по основной, но и по побочным реакциям. Если же процесс проходит без изменения объема реакционной массы, то при расчете степени превращения и выхода можно пользоваться не количествами веществ, а их концентрациями.
Скорость превращения. Чтобы определить время, необходимое для достижения заданного выхода продукта или заданной степени превращения исходного реагента, необходимо знать скорость химико-технологического процесса. Она будет определять интенсивность протекания процесса.
Чтобы промышленный процесс был экономичным, он должен прово-диться какое-то ограниченное время (время процесса должно быть конеч-но ограниченным). Чем короче время проведения процесса, тем меньшие размеры должно иметь оборудование, которое предназначено для получения заданного количества продукта.
Скорость ХТП в общем случае зависит от скоростей всех составляющих этого процесса, т.е. от скоростей физических и химических процессов, которые определяются и гидродинамическими параметрами движения реагентов, и условиями перемешивания, и диффузией, и концентрациями, и температурой и прочими и прочими факторами, оказывающими влияние на массо- и теплоперенос. Поэтому в самом общем виде формула для расчета скорости процесса может быть представлена в таком виде:
![]() (*)
(*)
где
К-
коэффициент скорости процесса,
![]() -
движущая сила процесса. Коэффициент
скорости процесса зависит от области
протекания процесса и является функцией
очень многих составляющих:
-
движущая сила процесса. Коэффициент
скорости процесса зависит от области
протекания процесса и является функцией
очень многих составляющих:
K= f (k1, k2, kn1, kn2, … D1, D2, … D'1, D"2, …), здесь – k1, k2, kn1, kn2 - константы скоростей прямой, обратной и побочных реакций; D1, D2, D'1, D"2 - коэффициенты диффузии исходных реагентов к поверхности раздела фаз и продуктов реакции от поверхности раздела фаз.
При расчетах обычно выбирают основные параметры, которые наиболее сильно влияют на скорость процесса. Для гомогенных процессов или для гетерогенных, протекающих в кинетической области, К зависит лишь от констант скоростей основной и побочных реакций:
![]()
Для гетерогенных процессов, протекающих в диффузионной области, определяющее влияние на скорость будут оказывать коэффициенты диффузии газа или жидкости внутри более плотной фазы, поэтому:
![]()
Движущая
сила процесса в общем случае является
довольно сложной функцией текущих и
равновесных концентраций реагирующих
веществ, константы равновесия и других
параметров. В простейшем случае для
необратимой реакции первого порядка
![]() в кинетической области
в кинетической области
![]() , тогда уравнение (*) принимает вид:
, тогда уравнение (*) принимает вид:
![]()
Селективность (избирательность). Выход продукта характеризует полученный результат как долю от теоретически максимально возможного. При этом мы нечего не знаем о том, что произошло с той долей сырья, которая не превратилась в целевой продукт. С другой стороны, степень превращения характеризует убыль исходных веществ, но ничего не говорит о том, во что они превратились.
Количественную оценку целевой реакции по сравнению с побочными дает селективность. Различают полную, или интегральную, селективность, которая характеризует сложный процесс в целом за конкретный промежуток времени и мгновенную, или дифференциальную, селективность, которая характеризует соотношение основной и побочных реакций в данный момент времени.
Полная,
или интегральная, селективность
![]() - это отношение количе-ства исходного
реагента, израсходованного на целевую
реакцию, к общему количеству вступившего
в химические превращения реагента
- это отношение количе-ства исходного
реагента, израсходованного на целевую
реакцию, к общему количеству вступившего
в химические превращения реагента
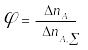 Мгновенной,
или дифференциальной, селективностью
Мгновенной,
или дифференциальной, селективностью
![]() называют от-ношение скорости превращения
исходных реагентов в целевой продукт
к общей скорости расходования исходных
реагентов
называют от-ношение скорости превращения
исходных реагентов в целевой продукт
к общей скорости расходования исходных
реагентов
![]()
Для характеристики эффективности процесса удобнее использовать показатель полной селективности.
Таким образом, селективность характеризует степень совершенства химического процесса. При отсутствии побочных реакций селективность равна 1. Во многих случаях оказывается выгодным вести процесс при невысоких степенях превращения, но высокой селективности, т.к. не прореагировавшее сырье можно вернуть в цикл, а целевой продукт не загрязнен побочными.
С другой стороны, попытки добиться максимального выхода продукта часто приводят к падению дифференциальной селективности в конце процесса и значительному загрязнению целевого продукта побочными. Это, в свою очередь, приводит к необходимости дополнительной очистки продукта и потере достигнутого выигрыша в выходе. Например, если производятся сотни тысяч тонн целевого продукта в год, то даже при очень редко достигаемой селективности катализатора 0,99 получаются тысячи тонн побочных продуктов. Отделение их от целевого продукта является весьма дорогостоящим и увеличивают число производственных стадий.
Между
выходом целевого продукта, степенью
превращения реагента и селективностью
существует простая связь:
![]()
Оптимальными значениями выхода, селективности и степени превра-щения будут, как правило, такие, достижение которых позволяет обеспе-чить максимальную экономическую эффективность процесса. Степень превращения, выход и селективность напрямую связаны с такими экономическими показателями эффективности производства, как расходные коэффициенты по сырью (количество каждого из видов сырья, необходимое для получения единицы готовой продукции) и материальный индекс производства (общее количество сырья, необходимое для производства единицы готовой продукции).
