- •Часть III
- •Введение
- •Потенциометрическое титрование
- •Лабораторная работа № 1 определение содержания аскорбиновой кислоты методом окислительно-восстановительного титрования
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 2 определение содержания стрептоцида методом окислительно-восстановительного титрования
- •Вопросы для контроля усвоения темы
- •Вопросы для контроля усвоения темы
- •Определение концентрации хлорид-ионов в растворах
- •Определение концентрации ионов no3− в сельхозпродуктах
- •Вопросы для контроля усвоения темы
- •Кондуктометрия
- •Вопросы для контроля усвоения темы
- •Изучение абсорбционных спектров растворов бихромата калия и перманганата калия
- •Определение хрома и марганца при совместном присутствии
- •Вопросы для контроля усвоения темы
- •Фотометрическое титрование
- •Лабораторная работа № 8 определение содержания меди
- •Определение меди
- •Вопросы для контроля усвоения темы
- •Тонкослойная хроматография
- •Техника выполнения анализа методом тсх
- •Лабораторная работа № 9 разделение галогенидов методом одномерной восходящей тсх
- •Вопросы для контроля усвоения темы
- •Приложение 1 Правила работы на кондуктометре
- •Калибровка электродов.
- •Выбор режима
- •Ионометрические измерения.
- •Приложение 4 инструкция по работе на сф-26
- •Определение оптической плотности
- •Переключение фотоэлемента
- •Переключение лампы
- •Приложение 5 коэффициенты распределения стьюдента
- •Значения q для исключения сомнительных результатов
- •Содержание
Лабораторная работа № 2 определение содержания стрептоцида методом окислительно-восстановительного титрования
Цель изучения данной темы
Усвоить основы потенциометрического окислительно-восстановитель-ного титрования. Овладеть навыками работы с установкой потенциометрического титрования, научиться строить кривые титрования, рассчитывать концентрацию определяемых веществ.
Материальное обеспечение
рН-метр или иономер.
Магнитная мешалка.
Мерная колба на 200 или 250 мл.
Мерная пипетка на 25 мл.
Мерная бюретка, 0-25 мл.
Бюкс для взвешивания.
Промывалки с дистиллированной водой.
Стаканы для титрования.
Фильтровальная бумага.
Бромид калия, кристалл.
Раствор нитрита натрия с установленной концентрацией.
Подкисленный раствор стрептоцида неизвестной концентрации.
Для определения содержания стрептоцида применяют метод потенциометрического нитритометрического титрования.
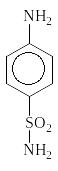
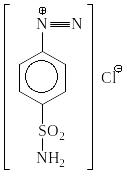
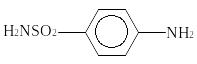
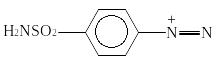
Количественное определение основано на способности стрептоцида, как первичного ароматического амина, образовывать в кислой среде диазосоединение.
|
+ 2HCl + NaNO2 |
|
+ NaCl + 2H2O |
|||
|
+ 2H+
+
|
NO + H2O |
|
|||
|
+ NO – |
|
+ H2O |
|||
Титрование проводят на холоду (не выше 20С) в среде соляной кислоты, чтобы предотвратить разложение соли диазония и потери азотистой кислоты. В титруемый раствор вносят бромид калия, который катализирует процесс диазотирования.
Полученный раствор-задачу разбавляют в мерной колбе до 200 мл.
В стакан для титрования отбирают пипеткой 10 мл приготовленного раствора стрептоцида, добавляют 1 г кристаллического бромида калия (взвешенного на технических весах). В полученный раствор помещают пару электродов: индикаторный платиновый и вспомогательный хлорсеребряный и медленно (по 0,1 – 0,2 мл !) титруют раствором нитрита натрия с установленной концентрацией.
По кривой титрования рассчитывают величину эквивалентного объема раствора нитрита натрия, пошедшего на титрование, а затем – содержание стрептоцида в исследуемой пробе.
m (C6H8N2SO2) = С(1/1 NaNO2)V(NaNO2)M(1/1 C6H8N2SO2)Vк10-3 / Vп ,
где С(1/1 NaNO2) – молярная концентрация эквивалента раствора нитрита натрия, моль/л;
V(NaNO2) - эквивалентный объем нитрита натрия, пошедший на титрование, мл;
M(1/1 C6H8N2SO2) – молярная масса эквивалента стрептоцида, г/моль;
Vк - объем мерной колбы, используемой для приготовления раствора стрептоцида, мл;
Vп - объем раствора стрептоцида, взятый для титрования, мл.
Представьте результаты анализа для доверительной вероятности 0,95.
Вопросы для контроля усвоения темы
Вид и построение интегральной кривой титрования стрептоцида раствором нитрита натрия.
Нахождение точки эквивалентности различными способами.
Приведите уравнения реакций, лежащих в основе метода и протекающих в процессе титрования.
Что представляет собой электрохимическая ячейка в данном случае титрования?
Строение и принцип действия электродов, используемых в данной работе.
Расскажите ход Ваших действий при проведении данной работы.
Приведите расчетные формулы, необходимые для вычисления содержания стрептоцида.
Лабораторная работа № 3
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ
АЦЕТИЛСАЛИЦИЛОВОЙ КИСЛОТЫ
МЕТОДОМ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Цель изучения данной темы
Усвоить основы потенциометрического кислотно-основного титрования. Овладеть навыками работы с установкой потенциометрического титрования, научиться строить кривые титрования, рассчитывать концентрацию определяемых веществ.
Материальное обеспечение
рН-метр или иономер.
Магнитная мешалка.
Аналитические демпферные весы с разновесами.
Мерная колба на 200 или 250 мл.
Мерная пипетка на 25 мл.
Мерная бюретка, 0-25 мл.
Бюкс для взвешивания.
Промывалки с дистиллированной водой.
Стаканы для титрования.
Химические воронки 40-50 мм.
Фильтровальная бумага.
Раствор щелочи с установленной концентрацией.
Раствор препарата (или порошок), содержащий ацетилсалициловую кислоту.
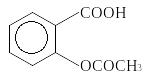
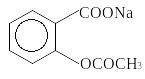
Для определения содержания ацетилсалициловой кислоты применяют метод кислотно-основного титрования с потенциометрическим окончанием.
|
+ NaOH |
|
+ H2O |
Ацетилсалициловая кислота плохо растворяется в воде, поэтому ее навеску, взятую на аналитических весах и количественно перенесенную в мерную колбу на 200-250 мл, необходимо сначала растворить в небольшом количестве спирта, затем довести объем в колбе до метки дистиллированной водой.
В стакан для титрования отбирают пипеткой 25 мл приготовленного раствора ацетилсалициловой кислоты, помещают пару электродов: индикаторный (стеклянный рН-чувствительный) и вспомогательный (хлорсеребряный) и титруют раствором гидроксида натрия или калия с известной концентрацией.
По кривой титрования рассчитывают величину эквивалентного объема раствора щелочи, пошедшего на титрование, а затем – содержание ацетилсалициловой кислоты в препарате (в граммах).
m(C9H8O4) = С(OH–)V(OH–)M(C9H8O4)Vк10-3 / Vп,
где С(OH–) – молярная концентрация раствора гидроксида натрия или калия, моль/л;
V(OH–) – эквивалентный объем раствора гидроксида натрия или калия, пошедший на титрование, мл;
M(C9H8O4) – молярная масса эквивалента ацетилсалициловой кислоты, г/моль;
Vк – объем мерной колбы, используемой для приготовления раствора ацетилсалициловой кислоты, мл;
Vп – объем раствора ацетилсалициловой кислоты, взятый для титрования, мл.
Рассчитывают массовую долю ацетилсалициловой кислоты в препарате:
(C9H8O4) = m(C9H8O4)100%/ m,
где m – масса навески исследуемого препарата, г.
Представьте результаты анализа для доверительной вероятности 0,95.